Магнитно-резонансная томография (МРТ) в Санкт-Петербурге

Запишитесь на МРТ по телефону (812) 493-39-22 или заполните форму

Расписание приема МРТ:
ЦМРТ Нарвская
(812) 493-39-22
Среда и воскресенье: с 08:00 до 23:00
ул. Ивана Черных, 29
МРТ аппарат 1,0 Тл
ЦМРТ Старая Деревня
ул. Дибуновская, 45
Четверг, суббота: с 08:00 до 23:00
МРТ аппарат 1,5 Тл
Возможности допплерографии
Ультразвук (УЗ) как и свет или рентгеновское излучение представляет собой волну. Как любая волна она имеет определённую длину и ширину. Скорость УЗ постоянна для каждой среды. Под действием УЗ волны наблюдается колебание частиц среды, через которую он проходит. Чем плотнее среда, тем выше её акустический импеданс, то есть отношение звукового давления к колебательной скорости. Чем больше разница акустических импедансов тканей, тем больше отражается УЗ на границе сред. Именно свойство отражения УЗ используется для диагностики. Коэффициент отражения называется эхогенностью ткани. Кость практически полностью отражает УЗ, что препятствует исследованию тканей, находящихся за ней. Положение границы ткани зависит от направления вхождения УЗ импульса и времени необходимого для его возврата. Кроме отражения значительная часть энергии УЗ поглощается тканями и рассеивается. Поглощение УЗ увеличивается с его частотой, поэтому УЗ волна постепенно затухает на глубине тканей. С другой стороны, с увеличением частоты возрастает пространственная разрешающая способность. Современные УЗ аппараты представляют собой сложные устройства, позволяющие получать качественное изображение и обрабатывать его. В УЗ аппарате компьютером генерируется электрический сигнал, который посредством датчика преобразуется в УЗ импульс. Датчик не только посылает, но и принимает УЗ сигнал, отражённый тканями. Для предотвращения отражения на границе датчика и тела, возникающего, главным образом, из-за воздушного зазора, используют специальный гель. Основной методикой УЗ обследования является В-режим – получают полипозиционное изображение срезов органа в серой шкале. Яркость отображения границы ткани зависит от её эхогенности. Последнее время появилась возможность трёхмерной визуализации. Оценивается эхо-структура, эхогенность и целостность анатомических структур. Визуализируют основные артерии, при этом определяют их ход (прямолинейный или извитой), их диаметр и структуру стенок. Помимо свойства отражения используется допплеровский эффект, то есть сдвиг частоты между принимаемым и передаваемым УЗ импульсами. На доплеровский сдвиг влияют скорость кровотока, излучаемая частота и угол ввода луча. Благодаря доплеровскому эффекту имеется возможность изучать гемодинамику.
Методика допплерографии и дуплексного сканирования сосудов
Основные принципы допплеровского метода
Впервые основы допплерографического метода исследования были изложены австрийским физиком Кристианом Допплером в 1842 году. В основу метода была положена идея о том, что при движении источника волн по отношению к воспринимающему устройству возникает частотный сдвиг. Допплеровским сдвигом частот называется относительное изменение исходной и воспринимаемой частоты ультразвуковых колебаний, которое пропорционально скорости движения источника ультразвука. В современных ультразвуковых допплеровских системах используют один датчик и для излучения, и для улавливания отраженной волновой энергии. В основе цветового допплеровского картирования лежит кодировка значений допплерографического сдвига частот определенным цветом с последующим наложением «цвета» на серошкальное изображение в режиме реального времени. Источником допплеровского сдвига частот является движение крови в венозных и артериальных сосудах. При этом окружающие мягкие ткани визуализируются различными оттенками серой шкалы, а сосуды, в зависимости от направления кровотока по отношению к датчику, окрашиваются в красный или синий цвет. Но у цветового допплеровского картирования есть недостатки, которые с успехом компенсируются возможностями энергетического картирования. Энергетический допплер (Power Doppler) это качественная оценка низкоскоростного кровотока, которая применяется для исследования сети мелких сосудов. На эхограмме отображается в оранжевом цвете, при этом более яркие оттенки свидетельствуют о большей скорости кровотока. К недостаткам цветового допплеровского картирования относятся – зависимость от угла локации (угол между осью сосуда и направлением ультразвукового луча); наличие шума, который дает беспорядочные отраженные шумовые сигналы ; феномен искажения спектра «aliasing». По своей природе ЦДК всегда зависит от угла сканирования. Допплеровский сигнал равен 0, если угол падения луча перпендикулярен направлению потока. Кровоток в сосудах, длинная ось которых направлена перпендикулярно углу локации, не регистрируется, а, значит, степень васкуляризации ткани может быть недооценена. Кодировка цветом также зависит от направления потока – при изменении хода сосуда в плоскости сканирования цвет потока изменяется, что приводит к усложнению визуализации сосуда. Феномен искажения спектра возникает когда аналоговый сигнал измеряется при частоте, в половину меньшей максимальной частоты излучения (предел Найквиста). При ЦДК, в этом случае, исследуемый сосуд выглядит прерывистым. Кроме того, эффект «aliasing» может изменять направление и показатели скоростей потока. И наконец «шумовые артефакты» – ими являются беспорядочно отраженные допплеровские сигналы, которые аппарат воспринимает как разнонаправленные потоки, следовательно, визуализация реального потока в сосуде практически невозможна. Все эти недостатки с успехом компенсирует энергетический допплер. При энергетическом картировании (ЭК) энергия шумовых сигналов значительно ниже, поэтому реальный поток крови регистрируется более отчетливо, чем беспорядочный шумовой сигнал, что расширяет динамический диапазон допплеровского исследования. Феномен «aliasing» не актуален для энергетического картирования, так как происходит интегральный подсчет всего допплеровского энергетического спектра. Но, при этом не стоит забывать, что информацию о направлении и скоростных характеристиках потока при ЭК мы не получаем. И наконец, энергетическая допплерография (ЭД) не зависит от угла локации, так как сигнал при этом формируется от всей массы движущихся частиц (эритроцитов ) в исследуемом объеме. ЭК дает возможность лучшей визуализации границ сосуда. Учитывая все перечисленное напрашивается вывод о том, что цветовое допплеровское картирование успешно регистрирует высокоскоростные потоки, но сосуды с низкими потоками регистрируются только энергетическим допплеровским режимом. Допплеровское исследование сосудов осуществляется с помощью специальных датчиков в зависимости от исследуемой области. Так, исследование сосудов головного мозга осуществляется с помощью низкочастотных (2-3 МГц) сфазированных датчиков. Транскраниальная допплерография (ТКДГ) измеряет скорость кровотока в сосуде, меняющуюся в соответствие с фазами сердечного цикла. Абсолютные скорости артериального кровотока при ТКДГ регистрируются при угле ввода луча 30-60°, ноопределяются исходя из сдвига частоты от движущихся элементов крови при нулевом угле. Получают скорость в центре сосуда, поэтому значения являются максимальными. Спектр допплеровского сдвига частоты отражается в виде развёртки скорости кровотока (см/с) во времени. Поток крови к датчику демонстрируется выше изолинии, от датчика – ниже изолинии. Чем уже и ярче полоса спектра допплеровского сдвига, тем более однородная характеристика кровотока, то есть скорость кровотока у элементов крови одинаковая. Расширение спектра и изменение его формы отражает качественное изменение гемодинамики. Качество ТКДГ зависит от правильной настройки аппарата. Наиболее важными из них являются увеличение мощности и цветности до соответствующего уровня. Настройка зоны фокуса в пределах 6-8 см улучшит пространственное и цветовое разрешение. Поддержание маленькой величины сектора и ширины цветового спектра будет сохранять максимальную частоту кадров. Проверка соответствия цвета мощности радиочастотного луча, чувствительности и постоянства установок также важно для качественных доплеровских изображений. Большой контрольный объём используется для получения хорошего отношения сигнал-шум. Цветная ТКДГ известна с 1989 года. Цветной дисплей важен, так как он помогает правильному расположению доплеровского контрольного объёма. Интерпретация ТКДГ исходит из информации, которую несёт спектральная волна. Таким образом, доплеровские сигналы получаются с разных глубин по ходу сосуда. Цветной дисплей помогает оператору, так как доплеровский контрольный объём проходит сквозь внутричерепные сосуды для получения доплеровской спектральной волны. Для каждой глубины важно настроить положение контрольного объёма на цветном дисплее и угол датчика, чтобы оптимизировать доплеровский сигнал. Общепринятой ориентацией цвета служит красный, указывающий кровоток в направлении датчика, и синий, указывающий направление кровотока от датчика. Сохраняя такую кодировку цвета легко определить направление кровотока в артериях. Методика ДС состоит из трёх режимов, иногда объединяемых термином «триплексное сканирование»:
- В-режим – получают полипозиционное изображение анатомических структур мозга в серой шкале. Оценка их эхоструктуры, эхогенности и целостности собственно мозга не имеет большого значения, так как патологию мозга выявляют томографическими методами. Однако, сонография в В-режиме из разных доступов позволяет точно найти исследуемую артерию и проследить её ход. На отображение кровотока влияет много настроек. Поэтому определение размера сосуда является неточным. Определяют ход (прямолинейный или извитой) артерий, их диаметр и структура стенок.
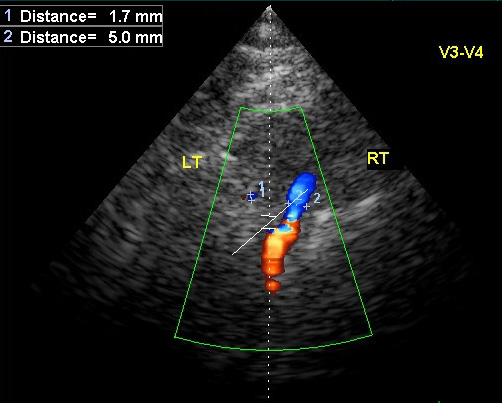
- Цветное допплеровское картирование с импульсной допплерографией – получают спектр кровотока в артериях мозга. ДС позволяет наложить маленькое окно (например, 5-10 мм) на определённый участок артерии, который легко устанавливается по цветному отображению кровотока. Из спектральной кривой определяют основные допплеровские показатели.
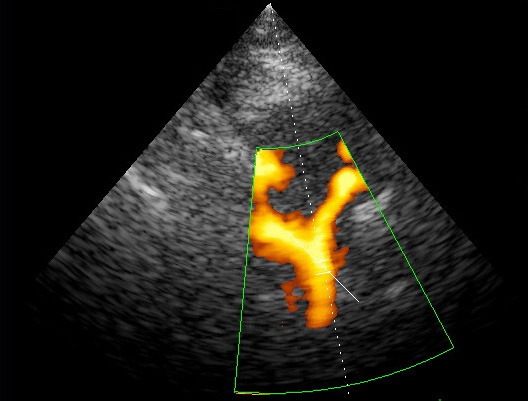
- Энергетический допплерный режим (Power Doppler) –изображение сосудов получают на основе отражённого допплеровского сигнала без учёта скорости и направления потока. В цвете кодируется энергия доплеровского сигнала. Этот режим отличается высокой чувствительностью и позволяет визуализировать потоки с низкой скоростью, в частности коллатеральный кровоток. Комбинируя энергетический допплеровский и В-режим, можно определять угол ввода луча.
Применительно к ДС существует методика контрастирования. Она представляет собой введения препарата, состоящего из микропузырьков, покрытых оболочкой. Контрастное усиление не нашло широкого применения, так как метод не дает очевидных преимуществ
Количественные показатели кровотока
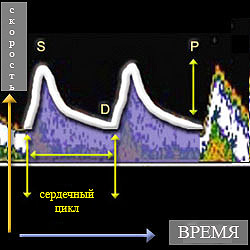
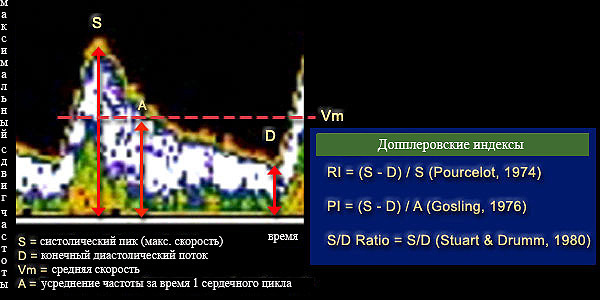
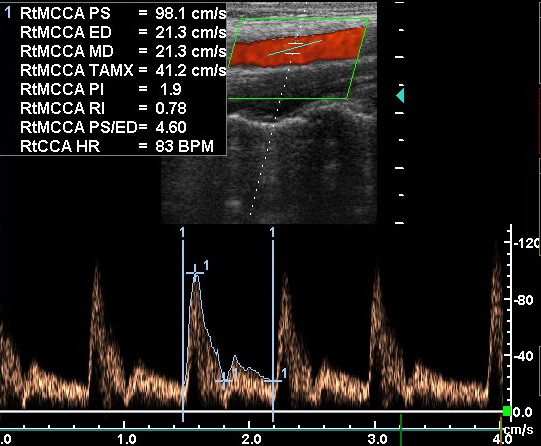
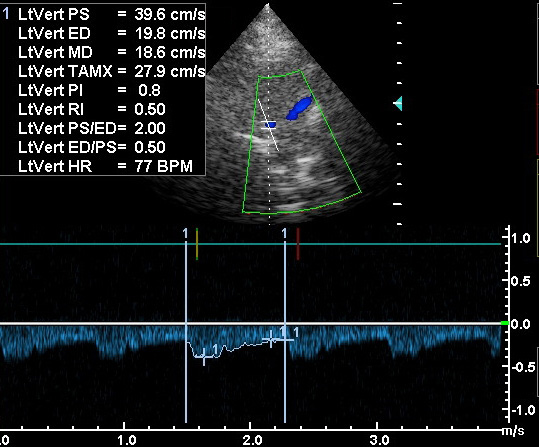
Импульсная допплерография даёт абсолютные количественные значения кровотока: среднюю скорость (ССК, Vmeanили TAV), максимальную систолическую скорость (МСС, Vmaxили PSV), конечную диастолическую скорость (КДС, Venddили EDV). На основе абсолютных показателей по стандартным формулам рассчитывают относительные показатели – индекс резистивности ( RI) , пульсационный индекс ( PI) и коэффициент асимметрии между правой и левой стороной. Пульсацию описывает форма спектральной волны, которая будет нормальной при МСС>КДС, пикообразной при МСС существенно большей КДС и уплощённой при КДС>50% МСС. Пульсационный индекс (PI) был впервые описан Gosling с соавт.(1976). Он был создан ими с целью подсчёта доплеровских волн при исследовании артерий нижних конечностей. ПИ рассчитывается как ПИ = (МСС-КДС) / ССК, при этом ССК определяется как максимальная скорость кровотока, усреднённая за время сердечного цикла. При использовании ПИ учитывается сопротивление возникающее при каждом сердечном цикле. Например, сниженный кровоток дистальнее места обструкциибудет иметь низкое значение ПИ (диастолическая скорость больше пиковой систолической на 50-60%). Допплеровский сигнал, полученный проксимальнее участка высокого сопротивления (например, повышенное внутричерепное давление), однако, будет иметь повышенное ПИ (пульсирующая спектральная волна). ПИ в СМА в норме находится в пределах 0,5-0,8. ИС – ещё один важный расчётный показатель. Он определяется как ИС= (МСС-КДС)/МСС, где МСС – максимальная систолическая скорость, КДС – конечная диастолическая скорость. Различие в ПИ и ИС только в знаменателе формул, ПИ использует усреднённое значение, в то время как ИС – максимальное. Вместо ИС и ПИ можно использовать соотношение МСС к КДС. Каждое учреждение должно решить какие значения скоростей оно будет использовать и применять соответствующие диагностические критерии.
Ультразвуковая картина основных типов сосудистой патологии
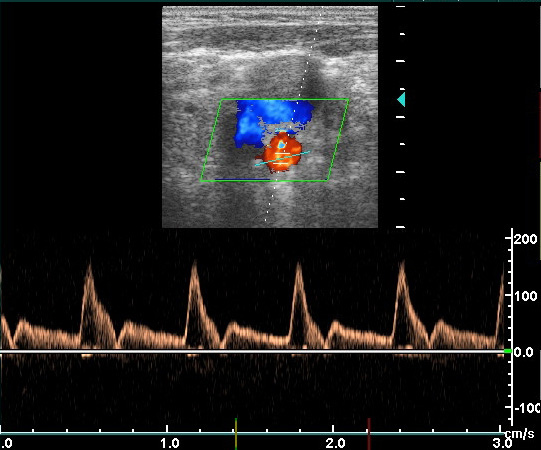
Транскраниальная допплерография (ТКДГ) – неинвазивный ультразвуковой метод измерения скоростей кровотока и его направления в крупных внутричерепных сосудах. С тех пор как в 1982 году Aaslid впервые показал ТКДГ внутричерепных артерий, она стала поистине массовым методом исследования артериального кровотока. Напротив, в области изучения венозного кровотока ТКДГ делает первые шаги. Огромным прогрессом в изучении сосудов явилось дуплексное сканирование, сочетающее возможности ультразвуковой визуализации и допплеровского измерения скоростей кровотока. ТКДГ зависит от умения и опыта исследователя. Главными преимуществами ТКДГ являются: возможность применения у кровати пациента, повторять по мере необходимости, осуществлять мониторирование. Кроме того, метод дешевле других и рутинно не требует контрастирования. Главными ограничениями ТКДГ являются использование только для крупных сосудов, хотя именно в них и возникают изменения. Данное ограничение относится также к МРА и КТА. Даже ДСА может быть не полностью информативной, если не все сосуды, имеющие отношение к патологическому процессу, целиком визуализируются. Применяя ТКДГ надо всегда помнить, что значения скоростей кровотока, полученные для конкретной артерии, не абсолютно отражают истинный кровоток. Кровоток зависит от многих факторов. Однако измеряемые при ТКДГ скорости кровотока и расчетные показатели хорошо коррелируют с выраженность патологических процессов в сосудах. ТКДГ является важным инструментом подтверждения смерти мозга. ДС сосудов шеи очень популярная методика в неврологии. При ДС хорошо видна извитость, петлеобразование и гипоплазия позвоночных артерий. Атеросклеротические бляшки, локализующиеся, как правило, в области бифуркаций общей сонной артерии и начальной части внутренней сонной артерии могут быть выявлены и охарактеризованы на предмет изъязвления и вероятности отрыва. Степень стеноза при ДС оценивается с достаточной точностью. Другой наиболее распространенной областью применения ДС служит выявление и оценка атеросклеротического поражения нижних конечностей, что является распространенной патологией в пожилом возрасте. Частота в популяции у лиц старше 50 лет составляет около 1%. Атеросклероз поражает преимущественно бедренную и подколенную артерии. Атеросклеротическая окклюзия чаще всего наступает в области гунтерова канала. Просвет артерии может быть сужен ограниченной атероматозной бляшкой, либо полностью закупорен с образованием восходящего тромба. Гораздо реже оккклюзия связана с облитерирующим эндартериитом, тромбангиитом (болезнь Бюргера) или неспецифическим аортоартериитом. В процесс чаще вовлечены артерии голени. Облитерирующим эндартериитом болеют почти исключительно молодые мужчины от 20 до 40 лет. Клинические проявления при окклюзии артерий нижних конечностей сводятся к перемежающейся хромоте разной степени выраженности, парестезиям, судорогам, похолоданию стоп. Клиническое обследование, включающее функциональные тесты, очень важно, так как дает представление о тяжести и компенсации процесса. Дальнейшее лучевое исследование необходимо для уточнения локализации, протяженности и степени окклюзии, а также о развитии коллатералей. ДС является первым инструментальным методом подтверждающим окклюзию и выявляющим ее степень. Удвоение ПСС отражает 50% степень стеноза. При большой степени стеноза ПСС ниже его уровня уменьшается и время достижения ПСС замедляется. При очень больших степенях стеноза, таких как окклюзия, нормальная трехфазная допплеровская кривая меняется на монофазную, а также возрастает диастолическая скорость кровотока. Метод достаточно точен и особенно привлекает своей доступностью. Чувствительность и специфичность ДС в диагностики окклюзии и стеноза свыше 50% составляет80-90%. Полная окклюзия при ЦДК выявляется с чувствительностью больше90%. ДС может служитьдля отбора пациентов для чрезкожной ангиопластики и атерэктомия, контроля за выполнением интервенционной процедуры и последующего мониторирования результатов. Следующим этапом, при необходимости, может быть ангиографическое исследование. Дуплексное сканирование служит главным методом послеоперационной оценки состояния обходных сосудов. Искусственные обходные сосуды легко визуализируются при УЗ исследовании. УЗ исследование в серой шкале остается стандартом выявления периферических аневризм. Для аневризм характерен турбулентный поток в режиме ЦДК и короткий двунаправленный систолический сигнал на кривой допплеровского спектра сдвига частот. Артериовенозные фистулы вызывают зону повышенной скорости кровотока между артерией и соседней веной и, соответственно, снижение индекса сопротивления. Дистальнее артериовенозной фистулы ПСС имеет нормальные или сниженные значения. Может наблюдаться расширение приводящего артериального ствола и диаметра отводящей вены проксимальнее фистулы. Тромбоз глубокой вены – это наличие в вене коагулировавшегося сгустка крови (тромба). Частота тромбозов глубоких вен нижних конечностей в популяции составляет примерно 1 случай на 1000 человек. Тромбозы глубоких вен имеют несколько этиологических факторов. Главными из них служат замедление скорости кровотока (венозный стаз), повреждение сосудистой стенки и повышение коагуляционных свойств крови – «триада Вирхова». Тромбоз глубоких вен нижних конечностей развивается в 5–10% случаев варикозной болезни по причиневенозного застоя, обусловленного экстравазальной компрессией и препятствием оттоку крови. Реже наблюдаются тромбозы воспалительной этиологии, при нарушении системы гемостаза и прямом повреждении вен. Считается, что ряд факторов способствует развитию тромбоза глубоких вен. Благоприятные условия для развития тромбоза создаются при длительной иммобилизации, при курении, применении оральных гормональных контрацептивов. Риск развития тромбоза увеличивается с возрастом. Тромбоз глубоких вен опасен отрывом тромба с развитием тромбоэмболии легочной артерии (ТЭЛА). Примерно 90% случаев ТЭЛА обусловлены тромбозом глубоких вен. Хронический процесс приводит к венозной недостаточности. Активация системы гемостаза, которая приводит к развитию тромбоза, сопровождается появлением в кровотоке специфических маркеров. В клинической практике для диагностики тромбоза из всех маркеров активации гемостаза наибольшей степенью точности обладают D-димеры. Нормальные результаты теста на D-димер у лиц со слабовыраженной клинической симптоматикой заболевания являются основанием для исключения диагноза тромбоза вен. Около 40% таких пациентов не нуждаются в дальнейшем дообследовании. Стандартным подходом к обследованию пациентов с очевидным клиническим подозрением на тромбоз глубоких вен является выполнение ультразвукового исследования. Применение нашли и более сложные методы. КТ-венография обладает достаточно высокой точностью, но требует введения йодного контраста и сопровождается высокой лучевой нагрузкой. МР-венография дает много ложно-положительных результатов. Наиболее целесообразно её применение для исследования вен таза, где ультразвуковое исследование неэффективно. Классическая рентгеноконтрастная венография остается последним методом, выполняемым только по особым показаниям. Например, у тучных пациентов или при выраженном отеке ноги, когда ультразвуковое исследование дает неопределенные результаты.
ВОЗМОЖНОСТИ ДОППЛЕРОГРАФИИ В ИССЛЕДОВАНИИ НОВООБРАЗОВАНИЙ
КОСТНО-МЫШЕЧНОЙ СИСТЕМЫ
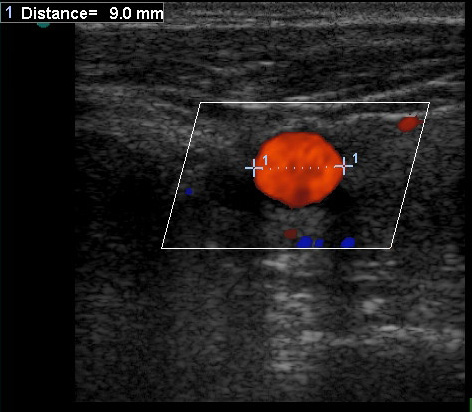
Диагностика новообразований костно-мышечной системы остается сложной и во многом нерешенной проблемой онкологии. Частота опухолей мягких тканей в общей структуре онкологической заболеваемости составляет около 5%. Доля ошибок на этапах диагностики достигает 60-90%. Это объясняется тем, что малого размера образования пальпаторно не определяются, поэтому долгое время остаются «бессимптомными». Образования больших размеров, особенно расположенные поверхностно, затрудняют дифференциальную диагностику с неопухолевыми образованиями. В настоящее время указать определенные клинико-диагностические признаки, позволяющие надежно дифференцировать злокачественные и доброкачественные новообразования костно-мышечной системы не представляется возможным. Статистика новообразований костно-мышечной системы говорит о значительном преобладании доброкачественных новообразований над злокачественными, а отсутствие онконастороженности у врачей первичного звена приводят к тому, что уточняющая диагностика часто запаздывает. Использование большинства современных методов визуализации, таких как КТ, МРТ, инвазивная ангиография, радионуклидные методы – сопряжено со значительной лучевой нагрузкой на пациента, с высокими материальными затратами и, в итоге, ограничивают повторное применение при динамическом наблюдении. Поэтому УЗИ является методом первичного выявления новообразования костно-мышечной системы, позволяющим получить большое количество информации об исследуемой области как при первичном обращении к врачу, так и при динамическом наблюдении. Дополнительную информацию, позволяющую повысить диагностические возможности ультразвукового сканирования, представляет исследование кровотока (в том числе и внутриузлового) в режиме цветового и энергетического допплеровского картирования.
Результаты исследования мягкотканых опухолей в В-режиме
При УЗ-исследовании в В-режиме в реальном масштабе времени выявляются определенные различия для злокачественных, доброкачественных и неопухолевой природы образований. УЗ семиотика злокачественных образований по данным рутинного УЗИ выглядит как гипоэхогенное (р<0,001), многоузловое (р<0,001), неправильной формы (р<0,001), с неровными (р<0,001) нечеткими или четкими контурами(р<0,05), с нарушенной разноплановой внутренней структурой и разнообразными включениями (р<0,001), с поражением костной ткани и признаками инфильтрации в близлежащие ткани (р<0,001), и сопровождающейся лимфоаденопатией в виде одиночных лимфоузлов в проекции регионарных зон лимфооттока. Семиотика доброкачественных новообразований по данным рутинного УЗИ в В-режиме складывается по частоте встречаемости из гипоэхогенных или гиперэхогенных образований (р<0,001), с четкими (р<0,001), ровными контурами (р<0,001), с однородной внутренней структурой (р<0,001), правильной формой (р<0,001), образования типично единичные (р<0,001), без признаков инфильтрации в окружающие ткани (р<0,001), и отсутствие лимфоаденопатии (р<0,001). Семиотика новообразований неопухолевой природы складывается из следующих УЗ-признаков в В-режиме серой шкалы: в подавляющем большинстве это гипоэхогенные образования (р<0,05), с неоднородной внутренней структурой (р<0,001), за счет присутствия гиперэхогенной взвеси (р<0,001) или без дополнительных включений (р<0,01), правильное или несколько реже неправильное узловое образование (р<0,001), чаще без выраженной реакции окружающих тканей или с отеком и нарушением эхоструктуры (р<0,001), без признаков инфильтрации (р<0,001), и чаще при условии воспалительной природы новообразования с единичными лимфоузлами на периферии(р<0,01). Показатели информативности В-режима в выявлении злокачественных образований составили по нашим данным : чувствительность 87%, специфичность – 91%, точность – 90,5%. В диагностике доброкачественных и неопухолевой природы образований чувствительность данного метода составила – 74%, специфичность – 90%, диагностическая точность – 83 %.
Методика допплерографического исследования образований костно-мышечной системы
Практически все процессы затрагивающие патологию костно-мышечной системы, сопровождаются, в той или иной степени, изменениями регионарного кровотока. Отсутствие или наличие кровотока помогает дифференцировать доброкачественные образования от злокачественных. Изменение уровня васкуляризации дает дополнительную информацию к ультразвуковому исследованию в режиме серой шкалы относительно воспалительных, посттравматических и инфекционных образований в костно-мышечной системе. Сегодня, УЗИ костно-мышечной системы должно быть дополнено допплерографическими исследованиями. Для этого используется линейный датчик с небольшой сканирующей поверхностью, с частотой от 7 МГц и выше. Во время проведения исследования необходимо сравнение параметров кровотока с контрлатеральной стороной. Использование большого количества геля, дает возможность избежать сдавления поверхностно расположенных исследуемых структур, а значит привести к неправильной оценке степени васкуляризации. Угол локации (угол между осью сосуда и направлением ультразвукового луча) не должен превышать 60 градусов, в противном случае параметры кровотока могут быть искажены.
Результаты исследования кровотока в новообразованиях костно-мышечной системы
Дополнительную информацию, позволяющую повысить диагностические возможности ультразвукового сканирования, представляет исследование внутриузлового кровотока в режиме энергетического допплера. Применение ЭД для дифференциальной диагностики злокачественных и доброкачественных новообразований мягких тканей возможно благодаря некоторым особенностям кровоснабжения злокачественных новообразований. Это большое количество мелких сосудов на единицу объема; преимущественно центральное расположение зон повышенной васкуляризации опухолевого узла и наличие более извитых сосудов мелкого калибра. Для оценки интенсивности кровоснабжения образований мы используем следующую шкалу: 1 тип – отсутствие локусов (аваскулярный тип кровоснабжения) 2 тип – единичные локусы (до 5 в поле зрения) 3 тип – множественные локусы преимущественно по периферии образования 4 тип – множественные локусы преимущественно внутри образования 5 тип – локация множественных локусов внутри и по периферии Большинство доброкачественных новообразований (липома, миксома, фиброма, синовиома) аваскулярны, либо имеют единичный питающий сосуд. Исключением являются опухоли гломуса и гемангиомы. Опухоли гломуса чаще всего локализуются в подногтевом ложе или мягких тканях пальцев (редко, в мышцах и подкожной клетчатке туловища и конечностей),- это производные нейромышечно-артериального гломуса. При допплерографическом исследовании они гиперваскулярны по периферии образования. Гемангиомы – доброкачественные сосудистые образования с разной степенью эхогенности от гиперэхогенных до смешанной эхогенности, «губчатой» структуры. При наличии флеболитов или преобладании капиллярных структур гемангиома выглядит как гиперэхогенное образование с ровным четким контуром. Смешанная эхогенность у гемангиом бывает при наличии щелевидных анэхогенных пространств, которые являются дилятированными сосудами. При цветовом допплеровском картировании определяется васкуляризация опухоли. При компрессии гемангиомы датчиком -исчезает сосудистый рисунок, так как кровь выдавливается из дилятированных сосудов. При прекращении компрессии кровь вновь поступает в сосуды, и появляются допплерографические сигналы. Плотность сосудистых структур в гемангиомах выше, чем в других опухолях. Следует различать гемангиомы капиллярного и кавернозного типа. Кровоток в капиллярных гемангиомах слабый, в виде единичных сосудов, а в кавернозных – лоцируется гиперваскуляризация. Большинство кавернозных гемангиом не опухоли, а сосудистые мальформации. Это сосудистые аномалии, появившиеся из эмбриональных капилляров, артериальных, венозных, лимфотических каналов или из их комбинаций в результате нарушений сосудистого эмбриогенеза. Как правило, они присутствуют уже при рождении ребенка, никогда не подвергаются инволюции и не являются опухолями. Отсутствие регистрируемых сосудистых структур так же характерно для некротических образований и низкодифференцированных опухолей. Поэтому отсутствие кровотока это не всегда основной признак доброкачественности образования. Злокачественные новообразования костно-мышечной системы при допплерографическом и энергетическом исследованиях характеризуются высокой степенью васкуляризации образований. Для оценки кровотока в образовании, подозрительном на злокачественное, с помощью цветового допплеровского картирования и энергетической допплерографии отмечают следующие моменты – наличие собственных сосудов в структуре опухоли, распределение сосудов в плоскости акустического среза (в двух взаимноперпендикулярных срезах) и отмечают характер их деления. В отдельных случаях лоцируется интранодулярно крупный питающий сосуд. Иногда, сосудистый компонент выглядит как множество «хаотично расположенных» цветовых сигналов по всему срезу опухоли. Чаще всего при локации злокачественного новообразования регистрируется выраженный регистрируемый интратуморозный кровоток с регистрацией 5-ти и более интенсивноокрашенных отдельных сосудов смешанного спектра. Новообразованные сосуды выявляются как по периферии опухоли, так и в центре образования, но чаще это смешанный тип васкуляризации (сосуды и в центре, и по периферии узлового образования). Отличительной особенность неоваскулярных сосудов является их неравномерный диаметр, извитость, разветвленность и наличие артерио-венозных шунтов. С гистологической точки зрения часть сосудистых структур злокачественных опухолей характеризуются отсутствием мышечного слоя, и выглядят как тонкостенные синусоидоподобные сосуды. Наибольшие величины скоростных показателей были характерны для злокачественных образований (Vmax, Vmin , TAV, Vmax/Vmin ) , минимальные -для доброкачественных образований. RI – индекс сосудистого сопротивления , был почти одинаков во всех группах . PI – индекс пульсации был несколько выше в группе злокачественных образований. (p<0,05 ). Одной из важнейших задач консервативной терапии мягкотканных образований различной этиологии является возможность динамической оценки эффективности лечения. Сравнение степени васкуляризации сарком до, во время и после химиотерапии позволяет определить пациентов с неадекватной реакцией на проводимое консервативное лечение. Если после проведения химиотерапии показатели кровотока сохранялись на прежнем уровне, это говорило о плохой реакции организма на проведенное лечение. Снижение степени васкуляризации сосудов питающих опухоль свидетельствует о явлениях некроза участков опухоли. Это позволяет своевременно провести раннее хирургическое лечение или сменить схему химиотерапии. Таким образом, тщательно проведенное цветовое допплерографическое и энергетическое картирование в комбинации с данными УЗИ в В-режиме серой шкалы является информативным методом диагностики новообразований костно-мышечной системы, позволяющим уже при первичном обращении получить достоверную информацию и дифференцировать доброкачественные и злокачественные новообразования, хотя и не может заменить гистологическое и морфологическое исследование. Использование методики на этапах консервативного лечения позволяет вовремя внести коррективы в проведение адъювантной химиотерапии.
ВОЗМОЖНОСТИ ДОППЛЕРОГРАФИИ СОННЫХ АРТЕРИЙ
Ультразвуковое исследование сонных артерий осуществляется датчиком 4 МГц. При ТКДГ датчик устанавливают на 2-4 см ниже бифуркации ОСА, направляя краниально. СДСЧ выглядит узкой полосой частот, расположенной выше изолинии (то есть артериальной) в обе фазы сердечного цикла. ДС значительно облегчает локацию и позволяет визуализировать всю систему экстракраниальных сонных артерий. Справа исследование начинают с получения изображения брахиоцефального ствола в месте его отхождения от дуги аорты, располагая при этом датчик параллельно ключице. Слева получают изображения бифуркации подключичной артерии, располагая датчик параллельно её ходу. Далее переходят к поперечному сканированию и продвигают датчик вверх от уровня верхнего края ключицы до угла верхней челюсти. В поперечной плоскости ОСА видна в виде круга, с расширением перед её бифуркацией. Затем идёт раздвоение на 2 круга – НСА и ВСА. При продольном сканировании устье правой ОСА и весь её ход визуализируются сравнительно легко, в то время как ход левой ОСА часто S-образный. В режиме цветного доплеровского картирования ОСА равномерно окрашивается в красный цвет. В области бифуркации ОСА, НСА и ВСА, как правило, не лежат в одной плоскости. В режиме цветного доплеровского картирования в устье ВСА видна зона синего окрашивания, что отражает зоны обратных токов. ВСА легко отличима от НСА по большей скорости кровотока и, как правило, латеральному её расположению, большему диаметру и прилеганию к ярёмной вене.
Показания к применению ТКДГ и ДС:
- Диагностика внутричерепной патологии сосудов, включая скрининг детей с серповидно-клеточной анемией, выявление эмболии мозга, мониторирование вазоспазма при САК, мониторирование ЧМТ
- Оценка эффекта антикоагулянтной или тромболитической терапии
- Выявление и оценка степени стеноза экстрацеребральной ВСА, изучение гемодинамического влияния окклюзий экстрацеребральной ВСА на внутричерепной кровоток, оценка кровотока по внутричерепным коллатералям
- Изучение кровотока в вертебробазилярной системе, включая выявление подключичного обкрадывания, окклюзий ПА и ОА
- Мониторирование мозгового кровотока во время операций
- Мониторирование прекращения внутримозгового кровообращения (подтверждение смерти мозга)
- Выявление сосудов, питающих АВМ
- Проверка функционального резерва
- Мониторирование гидроцефалии у детей и оценка состояния шунта
Атеросклеротическое поражение сосудов
Цереброваскулярные заболевания, включая кровоизлияния, занимают второе место по причинам смертности. Кратковременное, до суток, нарушение питание мозга называется транзиторной ишемической атакой (ТИА). Главной причиной ТИА служит тромбоз, реже эмболия артерий. После ТИА имеется высокий риск повторной ишемии с развитием инсульта. Частота гемодинамически значимого атеросклероза артерий увеличивается с возрастом, составляет 5 на 1000 в возрасте 50-60 лет, и уже 100 на 1000 в возрасте 80 лет и старше.
Атеросклеротические бляшки локализуются, главным образом, в дистальной части ВСА. Выраженный (более 75%) стеноз может приводить к ишемии, что зависит не только от его степени, но и от наличия коллатерального кровотока. Отрыв материала бляшки может приводить к эмболии. Наибольшая вероятность инсульта имеется при эмболии артерий, расположенных дистальнее Виллизиева круга, так как они не имеют коллатералей. Атеросклероз может вовлекать и систему основной артерии. Здесь поражение чаще идёт по типу эмболической окклюзии в бассейне ЗМА.
ТКДГ и ДС показана всем пациентам с ишемической цереброваскулярной болезнью, включая ишемический инсульт и транзиторную ишемическую атаку (ТИА), а также пациентам без симптомов, но с высоким риском инсульта. Это связано с тем, что методы выявляют проксимальные интракраниальные артериальные стенозы, артериальные окклюзии, коллатерали и наличие микроэмболизации.
Экстракраниальный стеноз ОСА и ВСА
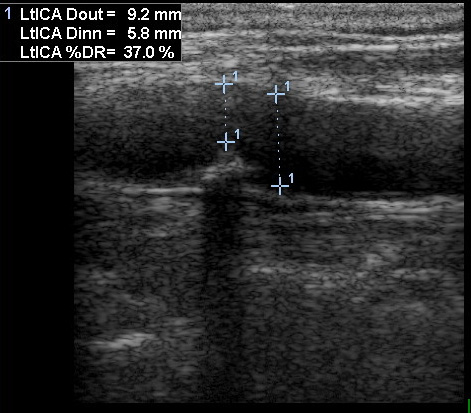
Экстракраниальный стеноз ОСА и ВСА эффективно выявляется методом ДС и томографическими методами. ДС и, особенно, сочетание ДС и МРА по чувствительности и специфичности очень близко к ДСА и может служить с целью неинвазивного скрининга. Степень стеноза определяется как отношение диаметра стенозированного участка к диаметру неизменённого участка артерии дистальнее стеноза. Кроме степени стеноза важно оценить протяжённость бляшки и выявить наличие изъязвления, так как оно увеличивает вероятность отрыва материала бляшки и эмболии.
В области стеноза изменяется кровоток. При значительных степенях стеноза наблюдается его ускорение и появление турбулентности. При субокклюзии (стеноз >90%), скорость кровотока снижается, при полной окклюзии кровоток прекращается. По скорости кровотока в ВСА стеноз оценивают следующим образом:
- Норма: МСС <125 см/с, бляшки или утолщения интимы не визуализируется.
- <50% стеноз: МСС<125 см/с, видна бляшка или утолщение интимы.
- 50-69% стеноз: МСС 125-230 см/с, видна бляшка.
- >70% стеноз и до субокклюзии: МСС>230 см/с, видна бляшка и сужение просвета ВСА.
- Субокклюзия: выраженное сужение просвета ВСА при ЦДК.
- Полная окклюзия: не видно просвета в В-режиме (серой шкале), нет потока при ЦДК , и ЭДС.
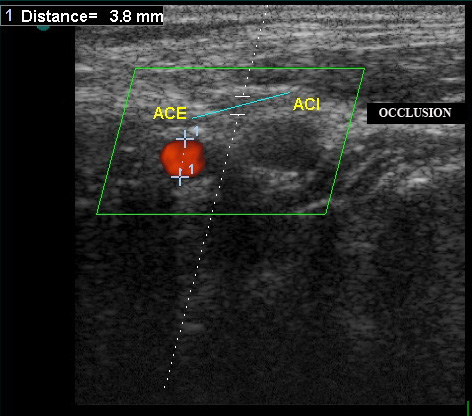
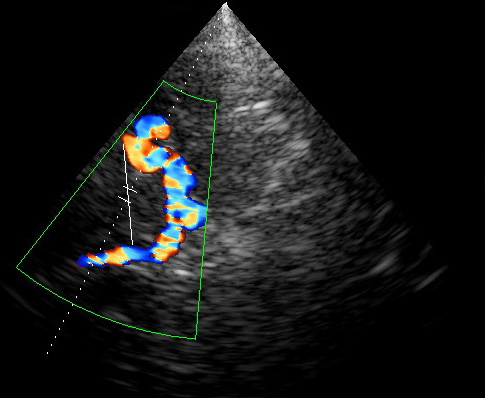
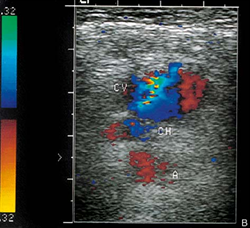
Окклюзия ВСА. Кровоток по ВСА отсутствует. Обозначения: ACI – ВСА, ACE – НСА. Поперечное сканирование в режиме ЦДК.
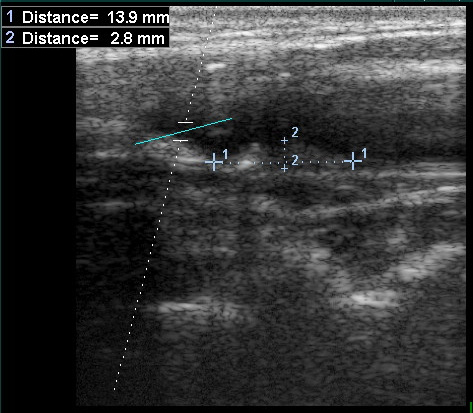
Атеросклеротическая бляшка в ОСА, протяженная, гетерогенная с участками кальциноза. Продольное сканирование, В-режим.
ВОЗМОЖНОСТИ ДОПППЛЕРОГРАФИИ ПОЗВОНОЧНЫХ АРТЕРИЙ
ОСОБЕННОСТИ АНАТОМИЧЕСКОГО ХОДА ПОЗВОНОЧНЫХ АРТЕРИЙ
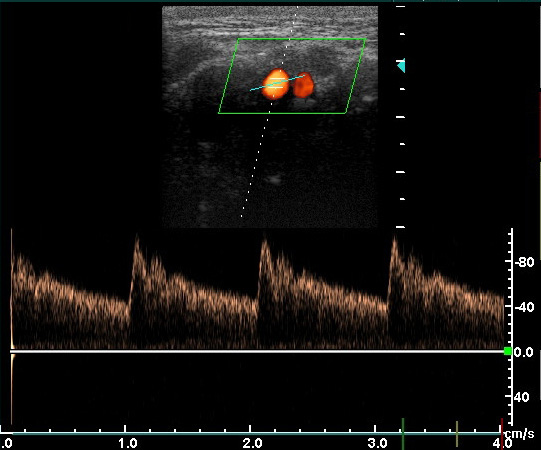
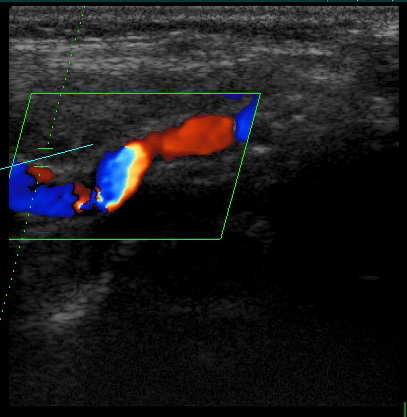
Позвоночные артерии (ПА) являются ветвями подключичных артерий, устье левой ПА расположено более проксимально, чем правой, левая ПА отходит под прямым углом, а правая – под острым. Только в 4% случаев ПА отходят от дуги аорты. Устье ПА является границей между первым и вторым сегментами подключичной артерии. ПА делятся на следующие сегменты: V1 – от устья до входа в костный канал поперечных отростков СVI (реже СV, СIV или СIII) шейного позвонка, V2 – в канале поперечных отростков от СVI до СII шейных позвонков, V3 – от выхода из канала поперечного отростка СII шейного позвонка до входа в череп через большое затылочное отверстие, на этом уровне ПА отклоняется кнаружи под углом 45˚, проходит по задней поверхности поперечного отростка атланта, меняет вертикальное направление на горизонтальное, делает дугообразный изгиб, называемый «петлей атланта», поворачивает вверх и вперед, прободает атлантоокципитальную мембрану и твердую мозговую оболочку. Изгибы ПА обеспечивают возможность движения головой и шейным отделом позвоночника, играют роль амортизаторов, сглаживая гемодинамические удары. V4 – интракраниальный отдел ПА от входа через большое затылочное отверстие до слияния с противоположной ПА в непарную основную артерию. Все сегменты ПА доступны дуплексному сканированию, наиболее легким для исследования является V2 сегмент. Канал ПА представляет собой пространство вокруг артерии, ограниченное с задней и наружной стороны костными образованиями, а передняя и наружная стенки канала – костно-мышечные. ПА в канале проходит вместе с венами, симпатическим сплетением и позвоночным нервом, раздражение которых приводить к спазму ПА. В большинстве случаев диаметр левой ПА больше, чем правой (70%), а диаметр правой ПА больше, чем левой в 18%. Поэтому именно левая ПА играет основную роль в кровоснабжении в вертебрально-базилярном бассейне. В среднем диаметр правой ПА равен 3,81±0,47 мм, левой – 3,88±0,47 мм. На экстракраниальном уровне ПА отдает ветви к мышцам, костному и связочному аппарату шейного отдела позвоночника. Наиболее крупные ветви ПА отдает на уровне V3 сегмента. Эти ветви участвуют в формировании анастомозов между ветвями наружной сонной артерии и подключичной артерии, их функционирование становится важным при патологии ПА. От интракраниального отдела ПА отходят ветви к твердой мозговой оболочке, задние и передние спинномозговые артерии, задняя нижняя артерия мозжечка. Перед слиянием в основную артерию ПА отдают ветви, соединяющиеся в переднюю спинномозговую артерию, в результате на передней поверхности продолговатого мозга образуется бульбарное артериальное кольцо.
МЕТОДИКА ДУПЛЕКСНОГО СКАНИРОВАНИЯ ПОЗВОНОЧНЫХ АРТЕРИЙ
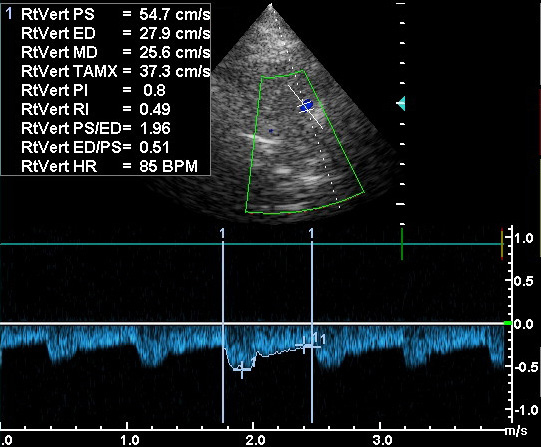
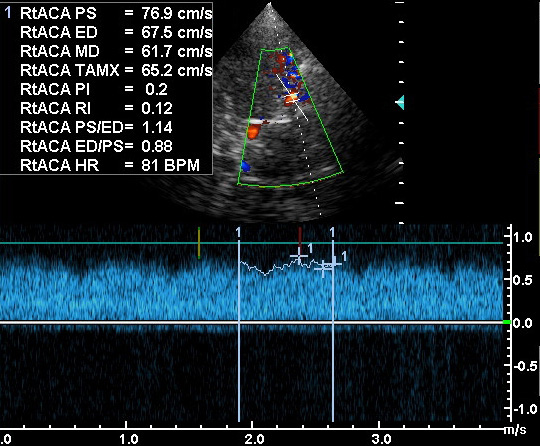
Позвоночная артерия сканируется в продольном сечении из переднебокового доступа в положении пациента на спине, начиная со второго сегмента с переходом на первый сегмент, место ее отхождения от подключичной артерии, а затем третий сегмент в области «петли атланта». Используют линейный датчик с переменной частотой 5-7,5 МГц. V2 сегмент ПА четко визуализируется вместе с сопутствующей веной между акустическими тенями тел шейных позвонков. Третий сегмент ПА лоцируется из заднего доступа за сосцевидным отростком. Лучше использовать датчик с частотой 5 МГц, устанавливая его под сосцевидным отростком и сзади, наклоняя к противоположной глазнице при легком повороте головы в другую сторону. Интракраниальный сегмент ПА сканируется секторным датчиком с частотой 2-2,5 МГц, который располагается ниже затылочного бугра и наклоняется к глазнице Из этого же доступа лоцируется основная артерия. Сканирование можно производить в положении сидя, при этом голова пациента наклонена вперед или в положении лежа на животе, подбородок приведен к груди. Исследование ПА проводят в В-режиме и режиме ЦДК. В В-режиме оценивают состояние стенки ПА и внутрисосудистых образований, в режиме ЦДК уточняют особенности ее хода, выявляют зоны турбулентного кровотока. Исследование V3 сегмента часто возможно только в режиме ЦДК. После визуализации ПА изучают спектральные характеристики кровотока, в норме кровоток по ПА монофазный с высокой диастолической скоростью. Затем проводят количественную оценку кровотока при условии правильного выбора угла локации. Угол локации должен составлять от 30˚ до 60˚. К количественным характеристикам кровотока относят: пиковую систолическую скорость кровотока (Vрs), конечную диастолическую скорость кровотока (Vеd), усредненную по времени максимальную скорость кровотока (ТАМХ), усредненную по времени среднюю скорость кровотока (ТАV), объемную скорость кровотока (Vvol), время ускорения (АТ) и индекс спектрального расширения (SBI). Уровень периферического сопротивления характеризуют следующие показатели: индекс пульсации Гослинга (РI), индекс резистентности Пурсело (RI) и систоло-диастолическое соотношение (S/D).
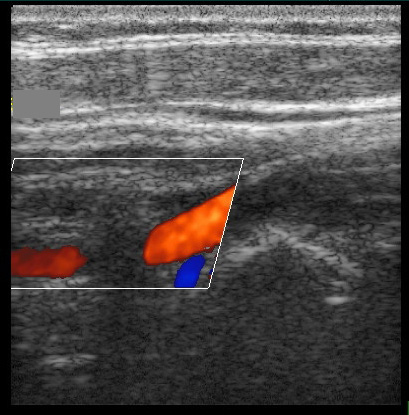
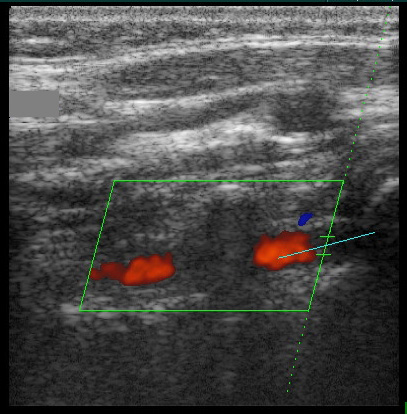
ПА в сегменте V1-V2 (вхождение в канал поперечных отростков на уровне С6). Продольное сканирование в режиме ЦДК.
АНОМАЛИИ ПОЗВОНОЧНЫХ АРТЕРИЙ
Чаще всего среди аномалий строения ПА встречается ее гипоплазия, которая характеризуется уменьшением диаметра до 2 мм и менее Частота гипоплазии ПА в популяции составляет около 10% (Верещагин Н.В., 1980), поэтому патологические изменения второй ПА ведут к срыву компенсации кровообращения в вертебрально-базилярном бассейне. ПА диаметром от 2 мм до 3 мм принято называть артерией «малого диаметра». При исследовании кровотока в ПА «малого диаметра» могут быть определены 4 основных типа кровотока:
- отсутствие изменений скоростных и спектральных параметров кровотока в сравнении с контралатеральной ПА,
- скоростные параметры кровотока снижены, индексы периферического сопротивления соответствуют нормативным значениям,
- отмечается повышение величин индексов периферического сопротивления по типу кровотока «затрудненной перфузии», пиковая систолическая скорость может соответствовать нормативным значениям, а максимальная конечная диастолическая и усредненные скорости кровотока снижены,
- снижение скоростных параметров кровотока – систолической, диастолической и средней скоростей кровотока, индексы периферического сопротивления повышены.
Тип кровотока, вероятно, определяется анатомическими особенностями строения сосуда, состоянием дистального русла и степенью гемодинамической перестройки системы мозгового кровообращения. Четвертый тип кровотока, как правило, встречается в ПА, которая заканчивается на уровне входа в череп мышечными ветвями либо задней нижней артерией мозжечка, не принимая участия в кровоснабжении мозга. Клинически гипоплазия ПА чаще всего проявляется при присоединении вторичной сосудистой патологии (атеросклероз, гипертоническая ангиопатия, экстравазальные влияния). При этом развивается хроническая недостаточность кровообращения в вертебрально-базилярной системе. Описанную морфологическую (первичную) гипоплазию ПА необходимо дифференцировать с функциональной (вторичной), которую могут вызывать стеноз более 70%, окклюзия в устье ПА или в V1 сегменте. В основе развития вторичной гипоплазии лежит недостаточность объемного кровотока дистальнее зоны поражения. К аномалиям хода относят аномалии вхождения ПА в канал поперечных отростков шейных позвонков и аномалии отхождения ее от подключичной артерии. При ультразвуковом исследовании диагностируется аномалия вхождения ПА в канал поперечных отростков шейных позвонков – вхождение на уровне С2-С5-позвонков, наиболее часто на уровне С5-позвонка. При этом V1 сегмент ПА обычно располагается непосредственно под общей сонной артерией и перед входом в костный канал делает угловой изгиб. При аномалии вхождения ПА в костный канал нельзя исключить возможность мышечной компрессии просвета артерии в сегменте V1 при поворотах и запрокидывании головы, что может явиться причиной транзиторного дефицита кровотока при недостаточности компенсаторной функции контралатеральной ПА. Аномалии отхождения ПА встречаются реже: отхождение ПА от общей сонной артерии той же или противоположной стороны, плечеголовного ствола, дуги аорты, удвоение артерий (в нашей практике было два наблюдения удвоения ПА). Частота всех аномалий отхождения составляет 8% (Верещагин Н.В., 1980). Наличие и степень выраженности дистальных гемодинамических нарушений при всех видах аномалий определяется состоянием контралатеральной ПА, степенью выраженности коллатеральной и функциональной компенсации.
СТЕНООККЛЮЗИРУЮЩИЕ ПОРАЖЕНИЯ ПОЗВОНОЧНЫХ АРТЕРИЙ
Чаще всего стенотические поражения ПА локализуются в области устья и в V1 сегменте, а также на уровне С1-позвонка. К спектральным характеристикам гемодинамически значимого стеноза (70% и более) относятся: уплощенный систолический подъем, ускорение скоростных показателей в зоне стеноза, заполнение спектрального окна вследствие турбулентности потока, снижение пиковой скорости дистальнее зоны стеноза. В режиме ЦДК регистрируется постстенотическая турбулентность и обратный кровоток около сосудистой стенки. Визуализация бляшки в устье ПА методом дуплексного сканирования часто затруднительна в связи с небольшим диаметром артерии и анатомическими особенностями расположения устья, поэтому в определение степени стеноза в основном основываются на спектральном допплеровском анализе.
При окклюзии (тромбозе) ПА кровоток в режиме ЦДК и по допплеру не регистрируется. При окклюзии просвет ПА может быть средней степени эхогенности или гиперэхогенный, возможна ее вторичная гипоплазия, при тромбозе просвет артерии чаще анэхогенный или гипоэхогенный. Окончательный диагноз устанавливается на основании клинических данных – острое нарушение мозгового кровообращения или хроническая недостаточность в вертебрально-базилярной системе. В настоящее время большое значение отводится микроэмболиям на фоне стенотических поражений ПА как одной из причин развития транзиторных ишемических атак и инсультов в стволе мозга.
ДЕФОРМАЦИИ ХОДА ПОЗВОНОЧНЫХ АРТЕРИЙ
В большинстве случаев деформации ПА выявляются в V1 сегменте (на его протяжении или в приустьевом отделе) и при выходе из костного канала на уровне V3 сегмента. Различают С-, S-, V-образные извитости, формирование петель и спиралей. Извитости могут быть врожденные и приобретенные при длительном течении артериальной гипертензии и возрастных изменениях стенок артерий. Дуплексное сканирование позволяет визуализировать форму извитости, оценить локальную и системную гемодинамическую значимость деформации. Форма извитостей может быть различной от небольшой С-образной приустьевой изогнутости до перегибов под острым углом с формированием септального стеноза. К патологическим относят извитости с ускорением скоростных показателей более 50% в области деформации, с изменением спектральных характеристик потока и со снижением скорости кровотока дистальнее извитости более 20% по сравнению с исходной скоростью кровотока, по изменениям гемодинамики они близки к стенотическим поражениям. Характер влияния деформаций ПА на системную гемодинамику зависит от уровня артериального давления. По нашим наблюдениям, в большинстве случаев при патологических извитостях ПА в приустьевом отделе дефицита кровотока в дистальном русле (на уровне V3-V4 сегментов и по ОА) не развивалось. Вероятно, компенсация кровотока происходит за счет коллатеральных ветвей ПА и функциональной компенсации (снижение уровня периферического сопротивления). Декомпенсация кровотока наблюдалась в случаях поражения контралатеральной ПА и при сочетании нескольких патологических факторов (стенотические поражения, гипоплазия, экстравазальные влияния).
ТРАВМАТИЧЕСКОЕ ПОВРЕЖДЕНИЕ ПОЗВОНОЧНЫХ АРТЕРИЙ
При травмах шейного отдела позвоночника возможно перерастяжение и надрыв стенки ПА, что ведет к ее расслоению. Ультразвуковая картина может быть разнообразна: от интрамуральной гематомы до окклюзии пораженного сегмента ПА, редко можно увидеть отслоившийся участок интимы. При переломах шейных позвонков выявляется выраженная деформация ПА до ее полной компрессии.
ОЦЕНКА ЛОКАЛЬНОЙ И СИСТЕМНОЙ ГЕМОДИНАМИКИ ПО ПОЗВОНОЧНЫМ АРТЕРИЯМ ПРИ ДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЯХ ПОЗВОНОЧНИКА
Дуплексное сканирование позволяет выявить экстравазальные влияния на стенку и просвет ПА: 1) сдавление стенки извне с развитием сужения просвета, 2) нарушение сосудистой геометрии в виде формирования деформаций и отклонения хода сосуда от его анатомической траектории, 3) ангиодистонические нарушения, проявляющиеся вазоконстрикторными реакциями при раздражении симпатических сплетений и позвоночного нерва. Метод позволяет достаточно объективно и достоверно диагностировать все виды экстравазальных воздействий, оценить их локальную и системную гемодинамическую значимость. Чаще встречается экстравазальное влияние на позвоночные артерии в канале поперечных отростков шейных позвонков, что является одной из причин развития хронической недостаточности кровообращения в артериях вертебрально-базилярной системы. При дегенеративно-дистрофических заболеваниях позвоночника происходит снижение высоты межпозвонковых дисков вследствие инволюционных изменений хрящевой ткани, появление остеофитов, деформация и смещения тел позвонков. Смещение и сужение просвета ПА остеофитами чаще всего происходит на уровне С5-С6-позвонков. Значение имеют боковые остеофиты, направленные в канал ПА, размер которых превышает 1,5 мм. Изменения в межпозвонковых суставах (спондилоартроз) оказывает меньшее влияние на ПА. Смещение и деформация хода ПА возможна при подвывихе суставных отростков по Ковачу, чаще на уровне С3-С4 и С4-С5-позвонков, в результате изменений в межпозвонковых суставах, приводящих к слабости связочного аппарата. До введения в клиническую практику ультразвуковых методов исследования диагностика экстравазальных компрессий основывалась на данных ультразвуковой допплерографии и ангиографии. Таким образом, на основе анализа кровотока по ПА у пациентов с дегенеративными изменениями позвоночника методом дуплексного сканирования следует говорить не столько об экстравазальной компрессии ПА, сколько об экстравазальных влияниях с развитием локальных гемодинамических сдвигов.У 35% пациентов экстравазальная компрессия сочеталась с атеросклеротическим поражением брахиоцефальных артерий (пациенты с гемодинамически значимыми стенозами, окклюзиями и патологическими извитостями сонных артерий не рассматривались), с деформациями ПА в приустьевом отделе и/или с аномалиями их строения, что приводило к развитию хронической недостаточности кровообращения в вертебрально-базилярной системе. Именно данной категории пациентов при неэффективности традиционной консервативной терапии показаны такие альтернативные методы лечения, как блокады звездчатого узла, оперативное лечение (фасетэктомия, лазерная вапоризация грыж дисков при сопутствующей компрессии корешков спинномозговых нервов).
ИССЛЕДОВАНИЕ КРОВОТОКА В СОСУДАХ ГОЛОВНОГО МОЗГА
Положение пациента.
ТКДГ выполняется при положении пациента лёжа на спине. Такое положение позволяет использовать транстемпоральное, трансорбитальное и субмандибулярное окна, в то время как для субокципитального доступа используются другие положения. Субокципитальный доступ может быть получен в положении больного лёжа на спине и голове, повёрнутой в сторону, либо склонённой к грудной клетке, а также в положении больного сидя и лёгком наклоне головы вниз. Лучше исследование выполнять в положении пациента лёжа.
Положение исследователя (оператора)
Оператор сидит рядом с головой пациента и кладёт локоть руки, в которой держит датчик, на кушетку. Такое положение фиксирует руку и позволяет избежать потери сигнала, а также двигательных артефактов. Кроме того, в таком положении обеспечен хороший доступ к голове с обеих сторон.
ТКДГ доступы
ТКДГ начинается с поиска ультразвукового окна. Полное ТКДГ исследование артерий включает 4 следующих доступа:
- Транстемпоральный
- Трансорбитальный
- Субокципитальный
- Субмандибулярный
В табл.1 приведены глубины измерения сосудов и средние скорости (см/с) в них в соответствие с доступом: Табл.1 Глубины измерения сосудов и средние скорости (см/с) в них в соответствие с доступом
| Окно | Артерия | Глубина (мм) | Средняя скорость (см/с) |
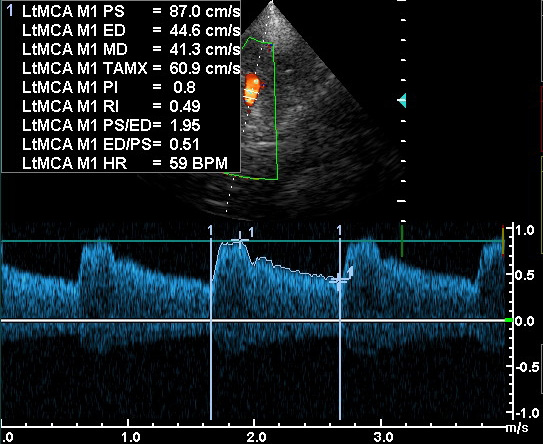
| Транстемпоральное | СМА | 30-67 | 62+/- 12 |
| ПМА | 60-80 | 50+/- 11 | |
| Терминальный отдел ВСА | 60-67 | 39+/-9 | |
| ЗМА | 55-80 | 39+/- 10 | |
| ЗСоА | |||
| ПСоА | |||
| Трансорбитальное | Зрительная | 40-60 | 21+/- 5 |
| ВСА (сифон) | 60-80 | 47+/- 10 | |
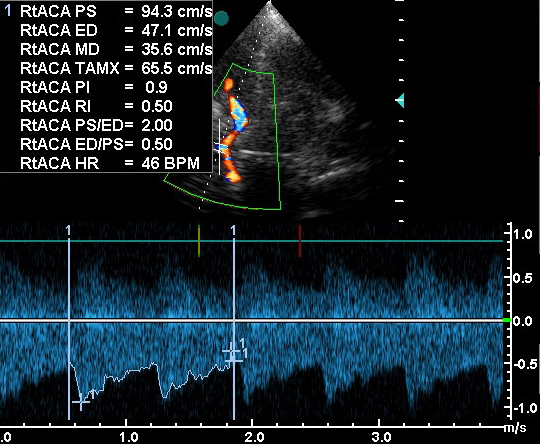
| Субокципитальное | Позвоночная | 40-85 | 38+/- 10 |
| Основная | >80 | 41+/- 10 | |
| Субмандибулярное | Дистальный отдел ВСА | 35-70 | 37+/- 9 |
Транстемпоральное окно
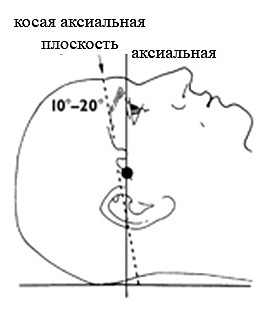
Транстемпоральный доступ осуществляется в положении больного на спине и при прямом расположении головы. Датчик размещается на височной кости кверху от дуги верней челюсти и кпереди от уха. Для хорошего контакта датчика с кожей надо обильно смазать гелем, особенно, если нужно менять угол ввода датчика для оптимизации доплеровского сигнала. Для прохождения сквозь чешую височной кости требуется максимальная акустическая интенсивность (100 мВт/см2). Поиск окна может быть затруднён, так как височная кость не всегда проницаема для ультразвука. Транстемпоральное окно у разных пациентов может быть разных размеров и по-разному располагаться, причём может быть неодинаковым с обеих сторон. Примерно у 30% пожилых женщин окно совсем не определяется, в то время как у мужчин окно проницаемо более, чем в 90% случаев. В транстемпоральном окне выделяют 4 зоны: лобную, переднюю, среднюю и заднюю. Через среднюю зону луч вводят почти (угол 10-20° каудально) перпендикулярно. Маркёр ориентации на датчике должен быть направлен вперёд, а угол его ввода чуть вверх. Такая ориентация датчика обеспечивает поперечную косую плоскость изображения, преимуществом которой является одновременная визуализация передней и задней циркуляции мозга у большинства пациентов. По отношению к истинной аксиальной проекции имеется небольшой наклон назад, что не очень сильно отличается от КТ и МРТ изображений. При боковом положении головы пациента плоскость изменится и будет сильно отличаться от анатомической. На мониторе полушарие со стороны датчика будет расположено в его верхней части, а противоположное полушарие – в нижней, причём передние отделы будут слева, а задние – справа. При хорошем транстемпоральном окне и установке глубины 14-16 см, противоположные от датчика кости черепа дают отражённые сигналы, расположенные на экране у основания картинки. Датчик, расположенный под углом, медленно перемещают по поверхности кожи в поисках наилучшего окна. Как только оно найдено, устанавливают размах глубины 8-10 см. У большинства больных можно увидеть артериальную систему с противоположной стороны, однако, каждое полушарие надо смотреть со своей стороны, для получения наилучшего угла артерия-датчик. В то же время, бывают случаи, когда окно имеется только с одной стороны и тогда используется только оно. При ДС, после того, как транстемпоральное окно найдено, датчик чуть наклоняют вниз для определения костных ориентиров. Эти анатомические структуры позволяют с уверенностью судить о правильном уровне по отношению к черепу для локализации виллизиева круга. Отражённое эхо расположенное спереди соответствует малому крылу клиновидной кости, а расположенное сзади – краю каменистой части височной кости. Височная доля той же стороны расположена в верхней части экрана. Выявление гиперэхогенной задней части сагиттального синуса позволяет ориентироваться в переднее-задней направленности внутричерепных структур. В поперечной плоскости в центре расположен гипоэхогенный средний мозг, имеющий форму бабочки окружённый гиперэхогенными цистенами. При направлении луча чуть ростральнее становится видным анэхогенный просвет III желудочка, окаймлённого гиперэхогенными эпендимальными выстилками. После визуализации перечисленных ориентиров, оптимизируют серую шкалу, используя ручки общей мощности (overall gain) и компенсации мощности во времени (times gain compensation). Идентификация артерии основывается на глубине её залегания, соотношении между сигналом от неё и от других внутричерепных структур, анатомических взаимоотношениях (терминальный отдел ВСА-СМА-ПМА), протяжённости видимого участка артерии до её разветвления, скорости и направлении потока, и реакции на компрессию и вибрацию ОСА. Компрессию ОСА осуществляют двумя пальцами на уровне пересечения грудино-ключично-сосцевидной мышцой ключицы, в сторону от трахеи, на протяжении 2-4 пульсовых ударов. Прекращение, уменьшение кровотока или обратный кровоток свидетельствуют о том, что найденный сосуд питается из системы ОСА. Данный приём не рекомендуется выполнять пациентам с низким расположением бифуркации ОСА, выраженным стенозом и нестабильными или изъязвлёнными атеросклеротическими бляшками. Начинают исследование с визуализации терминального отдела ВСА, в месте, где она проходит около рваного отверстия. Терминальный отдел ВСА расположен на глубине 60-67 мм, средняя скорость в норме 39+/- 9 см/с, а направление кровотока зависит от анатомической конфигурации артерии. Бифуркация ВСА залегает на глубине 60-65 мм и имеет двухстороннюю направленность потока. Затем датчик наклоняется вперёд и вверх, так, чтобы можно было исследовать оставшиеся сосуды передней циркуляции (СМА и ПМА). Крыло клиновидной кости может служить костным ориентиром, так как СМА проходит рядом с ним. Основной ствол СМА окрашивается красным, так как обычно кровоток идёт к датчику. Глубина обычно 30-67 мм, а средняя скорость в норме 62+/- 12 см/с. Идентификация СМА не составляет трудностей, так как она регистрируется на меньшей глубине по сравнению с другими артериями, легко прослеживается при небольшом перемещении датчика вверх от бифуркации ВСА и реагирует на компрессию и вибрацию ОСА. Имеется возрастная особенность хода СМА, что надо учитывать при ДС. Начинается СМА у медиального края малого крыла клиновидной кости, а затем у детей и молодых идёт латерально и несколько рострально, причем по ходу может изгибаться дорзально (Krejza et al., 2000). У пожилых горизонтальный сегмент СМА идёт прямо или изгибается вентрально, что больше соответствует ходу луча в косой аксиальной плоскости. Следовательно, в стандартной плоскости не всегда возможно проследить М1 сегмент СМА на всём протяжении и требуется индивидуальная коррекция ввода луча. Ветвь М2 СМА также обычно окрашивается красным, хотя может быть и синей, так как по её ходу в местах искривления кровоток может быть от датчика. ПМА при ДС отображается в оттенках синего цвета, так как она идёт в направлении от датчика. Для визуализации ПМА датчик бывает необходимо слегка наклонить кпереди и вверх. Обычно глубина составляет 60-80 мм, а средняя скорость в норме 50+/- 11 см/с, а цветовую мощность радиочастотного излучения (PRF) можно убавить, так как скорость кровотока в ней меньше. Дистальный фрагмент А1 сегмента ПМА часто не попадает в плоскость сканирования и не виден. Хотя исследование А2 сегмента ПМА не является рутинным, он обычно виден в межполушарной щели, идёт вперёд по средней линии и окрашивается синим. Встречаются случаи, особенно у пожилых пациентов, ошибочной диагностики гипоплазии А1 сегмента, что связано с поглощением ультразвука малым крылом клиновидной кости и не прокрашиванием артерии. Чтобы избежать такой ситуации надо сперва найти бифуркацию ВСА, затем М2 сегмент ПМА, а потом между ними расположить контрольный объём и получить полосу спектра. Несмотря на то, что передняя и задняя циркуляции могут визуализироваться одновременно, их надо смотреть порознь. Даже небольшое изменение расположения датчика на коже или изменение угла ввода, позволяют рассматривать переднюю и заднюю циркуляции независимо. Сосуды задней циркуляции визуализируются путём наклона датчика слегка назад и вниз, используя ножки мозга в качестве анатомического ориентира. Обычно обе ножки мозга одинаковы по размерам и форме и имеют промежуточную эхогенность. ЗМА окружает ножку мозга. Р1 сегмент ЗМА окрашивается красным поскольку кровоток идёт к датчику. Чтобы визуализировать ЗМА цветность может быть надо уменьшить, так как скорость кровотока меньше. Глубина обычно 55-80 мм, а средняя скорость кровотока 39+/- 10 см/с. Р2 сегмент ЗМА может также отображаться красным (к датчику) сразу дистальнее отхождения ЗСоА, но ещё дистальнее, когда она окружает ножку мозга, окрашивается синим. Эта вариабельность связана с искривлённым ходом артерии и сменой направления кровотока по отношению к датчику. Обычно ипси- и контрлателальный сегменты Р1 видны в месте отхождения, за бифуркацией ОА. Ипсилатеральный сегмент Р1 окрашивается красным, а контрлатеральный в оттенках синего. P1 сегмент нередко гипопластичен, поэтому часто проще начинать визуализацию ЗМА с P2 сегмента. ПСоА не визуализируется, так как она короткая. В то же время, ЗСоА длиннее и видна. ЛСК в ЗСоА составляет 36+/- 15 см/с, а направление кровотока может быть как к датчику, так и от него. Цветовую мощность радиочастотного излучения (PRF) может быть надо уменьшить для визуализации ЗСоА. Использование энергетического доплеровского исследования может быть полезно в лоцировании ЗСоА, так как она часто идёт параллельно линии кожи. ДС более точно, чем ТКДГ демонстрирует анатомию сосудистого русла. Коррекция угла ввода луча может давать точность скорости кровотока на 25-30% выше по сравнению с отсутствием коррекции угла. Тем не менее, может быть небольшая погрешность в связи с трёхмерностью хода внутричерепных сосудов. Ограничения ДС как и ТКДГ связаны с плохой проводимостью височного окна. Обычно ДС начинается с визуализации среднего мозга на глубине 5-9 см. Средний мозг имеет границу с высокой эхогенностью. Его окружают обе ЗМА, а ростральнее залегает ЗСоА. Важно помнить, что ДС даёт двухмерные изображения. Извитые внутричерепные сосуды часто не могут быть отображены в виде цветной линии по всей длине. Тогда исследователь направляет движение датчика, исходя из серой шкалы и цветных пикселей, для получения гемодинамической информации аналогично обычной допплерографии. Транстеморальное окно пригодно и для исследования кровотока в глубоких венах. После того, как идентифицирован P2 сегмент ЗМА, устанавливают низкие значения шкалы, мощности, фильтра и контрольного объёма для облегчения визуального и звукового определения венозного кровотока. Базальная вена (Розенталя) близко прилежит к P2 сегменту и важно их не спутать. После обнаружения вены с характерным кровотоком от датчика, регулируют положение датчика и глубину до получения наибольшего доплеровского сигнала. Базальная вена обнаруживается практически у всех пациентов. Скорость кровотока в вене Розенталя у взрослых варьирует от 4 до 17 см/с, в среднем составляя 10-12 см/с. Другой сосуд, также характеризуемый кровотоком от датчика, и видимый на глубине около 50 мм параллельно СМА, является глубокой средней веной мозга. Скорость кровотока в глубоких венных мозга такая же, как в вене Розенталя или чуть ниже.

Костные ориентиры при ДС в косой поперечной плоскости. Обозначения: Т(Д)- датчик, S(С) – сагиттальный синус, A- anterior, P – posterior, толстые головки – малое крыло клиновидной кости, чёрная стрелка – верхушка височной кости, чёрные головки – верхний край пирамиды, белые стрелки – задний отрезок сагиттального синуса и чешуя затылочной кости.
Субокципитальное окно
При изучении ВББ наилучшие результаты достигаются в положении больного лёжа на боку с головой, слегка наклонённой в сторону груди. Такое положение увеличивает расстояние между черепом и атлантом. Маркёр положения на датчике надо ориентировать в правую сторону пациента, а датчик надо поместить на заднюю поверхность шеи ниже шейной вырезки (crest). Наилучшее изображение получается при расположении датчика чуть парамедиально и угле ввода луча, направленном на переносицу пациента. Если исследуют обычной допплерографией без получение сонограммы, то датчик располагают ниже, а угол ввода луча направляют выше. Примерно у 5-6% пациентов субокципитальное окно непроходимо для ультразвука совсем, или недостаточно проходимо для получения адекватного изображения . Причиной прохой проходимости окна является короткая шея, плохая сгибаемость шеи вперёд в связи с артрозом и толстые связки. При ДС через большое затылочное отверстие видна большая округлая анэхогенная зона и яркое эхогенное отражение от затылочной кости. Глубина этих анатомических структур может быть у пациентов различной в зависимости от толщины мягких тканей. После того как найдены эти анатомические ориентиры, изображение в серой шкале оптимизируют ручками мощности (gain) и компенсации мощности во времени (TGC). Затем поворачивают ручку цветности и тогда правая ПА будет видна на мониторе слева, а левая – справа. ОА расположена глубже (в основании дисплея) по отношению к ПА. Размах глубины устанавливается 10-12 см. Кровоток в ВББ идёт обычно в направлении от датчика, поэтому артерии видны в синих тонах. ВББ имеет форму латинской буквы “Y”, но не всегда она видна целиком, особенно, дистальная часть ОА. Для её отображения нередко требуется дополнительный манёвр датчиком – сдвинуть чуть вниз и направить рострально. Важно помнить, что дистальная часть ОА залегает на глубине около 10 см, в то время как “Y”-образная бифуркация находится на глубине 7-8,5 см. Нередко наблюдается гипоплазия одной из ПА, что подтверждается исследованием экстракраниальных сегментов ПА. Изредка видны ЗНМА и ПНМА, но, как правило, их визуализация требует контрастирования. Контрольный объём помещают на ПА и получают спектральную информацию. Контрольный объём можно перемещать из стороны в сторону или проходить им по каждой артерии отдельно. Средняя скорость кровотока в ПА в норме 38+/- 10 см/с, в ОА – 41+/ 10 см/с. Так как в задней циркуляции скорость кровотока ниже, чем в передней, цветовую мощность кровотока надо уменьшить. В дополнение, исследователю может понадобиться подобрать расположение датчика на шее и угол ввода для визуализации дистального отдела ОА. Это достигается перемещением датчика вниз и направлением угла ввода вверх. При этом цветная доплеровская информация может теряться и тогда выполняют обычную допплерографию. Контрольный объём перемещают по ходу ОА. Терминальная часть ОА, там, где она делится на две ЗМА не видна из данного доступа.
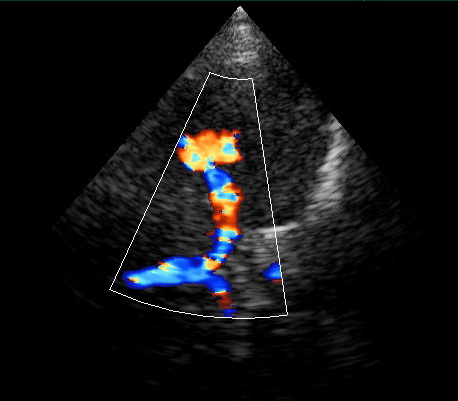
Слияние ПА и ОА в режиме ЭДС. Субокципитальный доступ. Визуализируются позвоночные и основная артерии.
Асимметрия интракраниальных сегментов ПА в связи с гипоплазией, контрлатеральная ПА компенсаторно расширена.
Трансорбитальное окно
Сонография через глаз возможна благодаря тому, что орбитальная поверхность лобной кости тонкая и в ней имеется отверстие. Трансорбитальный доступ даёт информацию о глазничной артерии и сифоне ВСА. Для данного доступа надо использовать только разрешённые для этого датчики. Хотя пока вредного воздействия на зрительный аппарат при ТКДГ и ДС не наблюдалось, всё-таки, при исследовании орбиты следует уменьшить мощность (10 мВт/см2) и работать быстро. Исследование выполняется в положении больного лёжа на спине. Датчик помещают на закрытое веко. Удаление перед исследованием контактных линз имеет значение только с точки зрения комфорта пациента. Количество геля должно быть достаточным, но сильное прижатие датчика необязательно. Непроизвольные движения глазных яблок вызывают артефакты, поэтому можно рекомендовать пациенту ориентацию взора в сторону, противоположную от стороны исследования. Маркёр положения на датчике должен указывать медиально, в направлении к носу, как при исследовании справа, так и слева. Исследование каждого глаза даёт картинку, на которой медиальная (со стороны носа) часть расположена слева, а височная – справа на мониторе. Вариантом методики служит ориентация датчика вправо при исследовании каждого глаза. Тогда при исследовании левого глаза медиальная часть (со стороны носа) будет на мониторе слева, а при исследовании правого глаза – справа. Глазное яблоко видно на мониторе в верхней части. Сифон ВСА расположен на глубине 60-80 мм. Средняя скорость кровотока составляет 47+/- 14 см/с. Направление кровотока зависит от изучаемого сегмента ВСА. В области колена направление кровотока двухстороннее, в параселлярном сегменте – в направлении к датчику, в супраклиновидном – от датчика. При исследовании ГА глубина контрольного объёма устанавливается 40-60 мм. Наилучшее отображение поверхностного сегмента получается с высокочастотным линейным датчиком (7,5-10 МГц). УЗ луч направляют слегка медиально в переднее-задней плоскости. ГА обычно выявляется примыкающей к зрительному нерву. Для визуализации ГА при ДС цветовую мощность радиочастоты надо уменьшить. Кровоток идёт в направлении к датчику, его средняя скорость 21+/- 5 см/с. Так как ГА кровоснабжает глазное яблоко, доплеровский сигнал имеет высокую пульсацию. Кроме ГА при ДС удаётся визуализировать заднюю ресничную артерию, слёзную артерию, центральную артерию сетчатки и измерить ширину зрительного нерва.
Субмандибулярное окно
Субмандибулярный доступ необходим для продолжения исследования экстракраниальной дистальной части ВСА. Датчик помещают под угол нижней челюсти и направляют чуть медиально и к голове, в направлении каротидного канала. Маркёр ориентации датчика направляют вверх. В дистальной части ВСА кровоток идёт в направлении от датчика и отображается в оттенках синего. Тщательное изучение доплеровского сигнала позволяет отличать сигналы с низким сопротивлением от ВСА от сигналов с высоким сопротивлением в НСА. Венозный кровоток в этой зоне меньше пульсирует и направлен к датчику (окрашивается в красные тона). Угол направления датчика надо регулировать для прослеживания хода ретромандибулярной части ВСА. Средняя скорость кровотока в этом сегменте ВСА составляет в норме 37+/- 9 см/с.
Исследование вен
Как уже описывалось выше глубокие вены можно исследовать из транстемпорального окна. Наиболее приспособлено для исследования венозной системы трансокципитальное окно. Исследуют больного в положении сидя с головой чуть наклонённой вперед. Датчик располагают примерно на 1 см выше наружного бугра затылочной кости. При ДС в сагиттальной плоскости можно визуализировать проксимальные отделы прямого синуса и дистальные отделы нижнего сагиттального синуса, большую вену мозга (Галена), а также внутренние и базальные вены. Прямой синус локализуют по средней линии с очень низким углом ввода луча. Направление кровотока идёт к датчику. Важно, чтобы при исследовании не накладывался доплеровский спектр от соседней с ней ЗМА. Выявляемость прямого синуса из трансокципитального окна составляет около 80%,что немного выше, чем через транстемпоральное окно. Нижний сагиттальный синус визуализируется там, где он впадает в прямой синус локализовать нижний сагиттальный синус надо сперва найти трифуркацию, состоящую из большой вены мозга (Галена), нижнего и верхнего сагиттальных синусов. Кровоток в нижнем сагиттальном синусе как и в верхнем также направлен к датчику. В вене Галена кровоток может быть направлен как к датчику, так и от него. Выявляемость глубоких вен из трансокципитального доступа очень низкая. Кровоток по внутренним венам мозга идет по направлению к датчику. Основные вены (Розенталя) из трансокципитального доступа можно попробовать увидеть в их заднем сегменте и имеют кровоток, направленный к датчику. Чтобы найти глубокую вену, сперва определяют вторую трифуркацию, состоящую из основной вены, внутренней вены и большой вены. Скорость кровотока в прямом синусе у взрослых составляет около 30 см/с, однако, с большим разбросом данных. У детей кровоток медленнее, 12-13 см/с. Скорость кровотока в вене Галена у взрослых составляет порядка 20 см/с, около 4 см/с у новорожденных, между 5 и 6 см/с у детей. В верхнем сагиттальном синусе скорость кровотока у новорожденных составляет около 9 см/с. Увеличение скоростей кровотока по венозной системе с ростом связывают с расширением вен. У взрослых с возрастом, напротив, скорость кровотока в венах постепенно уменьшается. Индекс сопротивления в венах и синусах низкий, но с большим разбросом данных. В целом, сопротивление в венах у взрослых с возрастом повышается.
ИССЛЕДОВАНИЕ КРОВОТОКА В ПЕРИФЕРИЧЕСКИХ АРТЕРИЯХ
Атеросклеротическое поражение нижних конечностей является распространенной патологией в пожилом возрасте. Частота в популяции у лиц старше 50 лет составляет около 1%. Атеросклероз поражает преимущественно бедренную и подколенную артерии. Атеросклеротическая окклюзия чаще всего наступает в области гунтерова канала. Просвет артерии может быть сужен ограниченной атероматозной бляшкой, либо полностью закупорен с образованием восходящего тромба. Гораздо реже оккклюзия связана с облитерирующим эндартериитом, тромбангиитом (болезнь Бюргера) или неспецифическим аортоартериитом. В процесс чаще вовлечены артерии голени. Облитерирующим эндартериитом болеют почти исключительно молодые мужчины от 20 до 40 лет. Клинические проявления при окклюзии артерий нижних конечностей сводятся к перемежающейся хромоте разной степени выраженности, парестезиям, судорогам, похолоданию стоп. Клиническое обследование, включающее функциональные тесты, очень важно, так как дает представление о тяжести и компенсации процесса. Дальнейшее лучевое исследование необходимо для уточнения локализации, протяженности и степени окклюзии, а такж о развитии коллатералей. Дуплексное сканирование является первым инструментальным методом подтверждающим окклюзию и выявляющим ее степень. Метод достаточно точен и особенно привлекает своей доступностью. Следующим этапом, при необходимости, может быть ангиографическое исследование.

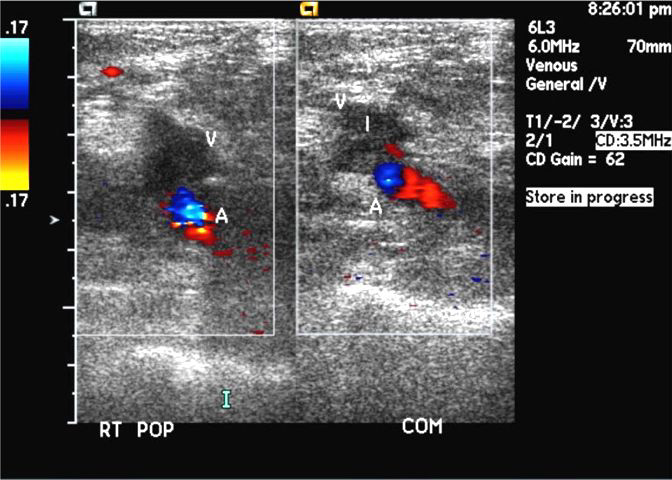
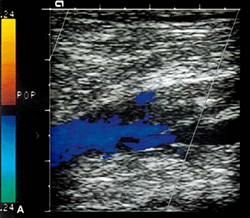
Сосуды нижней конечности в норме. Нормальная допплеровская кривая показана слева. Справа показана допплеровская кривая, типичнаядля окклюзии подколенной артерии.
Артериальный кровоток в нижних конечностях
Бедренная артерия условно разделяется на два сегмента: общая бедренная артерия – до места отхождения глубокой бедренной артерии, и поверхностная бедренная артерия дистальнее отхождения глубокой бедренной артерии. Глубокая артерия бедра представляет собой крупный сосуд, ветви которой ветви, кровоснабжают мышцы бедра и бедренную кость. Поверхностная бедренная артерия дает лишь ряд мелких ветвей, в том числе нисходящую артерию колена, участвующую в образовании сосудистой артериальной сети колена. В нижней трети поверхностная бедренная артерия отклоняется кзади, входя в бедренно – подколенный канал, образованный мышцами и связками приводящих мышц бедра. После выхода из канала бедренная артерия непосредственно продолжается в подколенную артерию. Диаметр бедренной артерии составляет 8-9 мм. Подколенная артерия находится в подколенной ямке, с помощью анастомозирующих между собой мелких ветвей, образует артериальную сеть колена. Она заканчивается в области отхождения передней большеберцовой артерии и непосредственно продолжается в заднюю большеберцовую артерию. Диаметр подколенной артерии 6-8 мм. От задней большеберцовой артерии отходит малоберцовая артерия. Передняя большеберцовая артерия в нижней трети голени выходит на переднюю поверхность, непосредственно продолжаясь в тыльную артерию стопы. Диаметр большеберцовых артерий варьирует от 1 до 4 мм. Кровоток в нижних конечностях типично трехфазный (табл.1). В систолическую фазу происходит характерное быстрое ускорение кровотока. В раннюю диастолическую фазу происходит смена направления кровотока. В период диастолы наблюдается антеградный кровоток низкой амплитуды. В позднюю диастолическую фазу кровоток может снижаться за счет сокращения сосудов в ответ на холод или, наоборот, возрастать за счёт расширения сосудов в ответ на физическую нагрузку. Пиковая систолическая скорость кровотока (ПСС) уменьшается со 120 см/с (но не больше 150 см/с), в среднем, в подвздошной и общей бедренной артерии, до 70 см/с, в среднем, в на уровне подколенной артерии. Спектральная кайма в норме четкая, без спектрального расширения и локального ускорения кровотока При лоцировании парных сосудов не должно наблюдаться существенной асимметрии ПСС. На диаграмме (рис.1) показаны основные артерии нижней конечности. Допплеровская кривая в норме изображена слева. Справа изображены кривые типичные для окклюзии подколенной артерии. Табл.1 Типы артериального кровотока и их кореляции с патологическими изменениями в артериальном сегменте.
| Тип кровотока | Состояние артериального сегмента |
| Трёхфазный сигнал | Нормальный сигнал в покое с ранним обратным систолическим потоком, указывающим на податливость дистального артериального русла и достаточный отток |
| Двухфазный сигнал с отсутствием диастолического потока | Спазм артерии дистальнее места измерения; острая артериальная обструкция дистальнее места измерения |
| Монофазный поток с отсутствием систолического обратного потока, но наличием антеградного систолического и диастолического потока («медленно-мало») | Расширение сосуда дистальнее окклюзии |
| Монофазный поток («стаккато») | Окклюзия артерии дистальнее места измерения, скорее острая или быстро нарастающая окклюзия |
| Монофазный протяженный поток | Наблюдается в артерио-венозных фистулах |
| Поток вперед в систолу и назад в диастолу («туда и обратно») | Обратный поток в шейке псевдоаневризмы в связи с ее податливостью |
В норме в В-режиме диаметр парных сосудов должен быть одинаковый или с незначительной асимметрией и без выбуханий стенок. Стенка сосуда визуализируется однородной равномерной и непрерывной на всем протяжении сосуда.
Окклюзия и стеноз
Отсутствие цветовых сигналов кровотока и пульсовых допплеровских сигналов подтверждает окклюзию в артериальном сегменте (табл.2,3). Сужение диаметра на 50% и больше рассматривается как гемодинамически значимый стеноз. При стенозе меньше 50% может наблюдаться некоторое расширение спектра допплеровской кривой. При стенозе больше 50% увеличивается пиковая систолическая скорость кровотока, что хорошо видно при ЦДК в точке наибольшего сужения. Дистальнее участка стеноза при ЦДК отчетливо видна струя на протяжении 2-4 см. В зоне 50% стеноза скорость кровотока возрастает на 100% по сравнению с нормальным участком, в зоне 75% стеноза – на 370%.
Табл.2. Корреляции между находками при дуплексном сканировании и состоянием артериального сегмента – выявление стеноза
| Находки при дуплексном сканировании | Состояние артериального сегмента |
| Увеличение ПСС свыше 200 см/с | Стеноз свыше 50% (для подколенной артерии ближе к 75%) |
| Увеличение ПСС на 100% (индекс ПСС 2 и больше) | Автоматическая калибровка диаметра артерии для нормализации к ближайшему нормальному артериальному сегменту |
| Уменьшение ПСС по двухфазному (высокое сопротивление) или монофазному (высокое сопротивление) типу | Стеноз расположен дистальнее основной коллатеральной ветви, измерение проводится дистальнее коллатерали, но проксимальнее или на уровне стеноза |
| Сигналы отсутствия потока (ложно-положительные для окклюзии и ложно-отрицательные для стеноза) | 1. Кальцификация2. Низкая чувствительность в связи с неправильной настройкой3. Субтотальная окклюзия |
| Увеличенные сигналы потока (ложно-положительные для стеноза) | 1. Для подколенной артерии моут быть связаны с внешней компрессией2. Петли |
Табл.3. Корреляции между находками при дуплексном сканировании и состоянием артериального сегмента – выявление окклюзии
| Находки при дуплексном сканировании | Состояние артериального сегмента |
| Цветовой кровоток и допплеровский пульсовой сигнал отсутствуют | Кровотока нет |
| Эхогенный сигнал в артерии | Тромбоз в связи с окклюзией, обычно, протяженностью между двумя большими коллатералями |
| Большая коллатеральная ветвь видна при ЦДК | Высокая вероятность дистальной окклюзии |
| Низкоамплитудный и постоянный антеградный поток в систолу и диастолу | Окклюзия, вероятно, проксимально месту измерения |
| Низкоамплитудный систолический сигнал в окклюзированном сегменте (ложно-отрицательный) | Сигнал связан с движением тромба в окклюзированном сегменте |
| Сигналы кровотока на уровне окклюзии (ложно-отрицательные) | В область измерения попала коллатераль |
| Не удается получить сигналы из открытого артериального сегмента (ложно-положительный результат) | 1. Низкая чувствительность в связи с неправильной настройкой2. Кальцификация3. Субтотальная окклюзия с перенаправлением потока от стеноза по коллатералям |
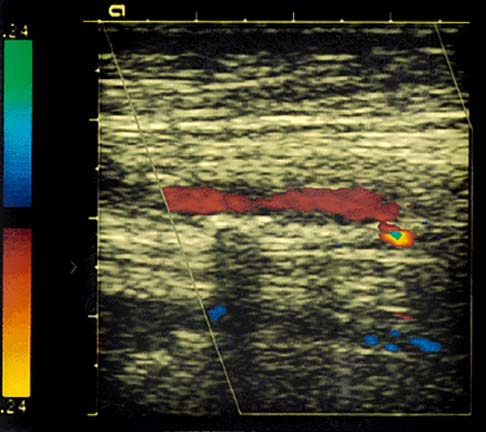
Изображение средней поверхностной бедренной артерии при продольном сканировании в ЦДК. Справа отсутствует кровоток – окклюзия. Сразу ниже участка окклюзии синим отображается коллатераль.
Бедренная артерия проксимальнее участка отсутствия сигнала. Типичная пульсовая допплеровская кривая с низкой амплитудой и высоким сопротивлением.
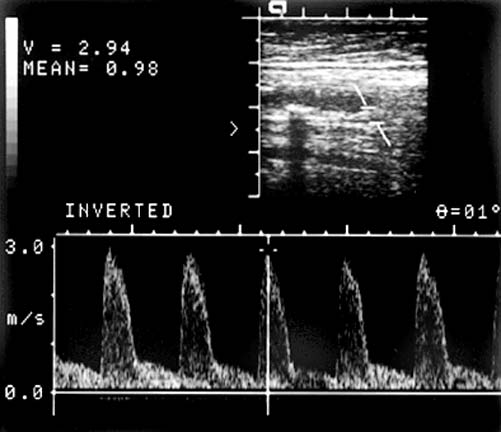
Кровоток в коллатерали . Типичная пульсовая допплеровская кривая с низким сопротивлением и высокой скоростью
Заболевания периферических артерий
Допплерография с ЦДК является методом выбора для выявления участков стенозов и определения тактики лечения. Точки отсечения и соотношения могут быть использованы для оценки степени стеноза и определения коррелятивных связей (табл.3). Для бедренных артерий точка отсечения обычно выбирается 200 см/с, при этом пиковая систолическая скорость кровотока в этом сегменте в норме составляет 110 см/с. Для подколенной артерии точка отсечения выбирается 150 см/с, так как скорость кровотока в ней в норме около 70 см/с. Коэффициент пиковых систолических скоростей более варьиабелен, так зависит от компенсации кровотока ниже сужения и сердечного выброса. Измерение систолической скорости кровотока в зоне предполагаемого сужения обычно делается с помощью ЦДК. Затем эта скорость сравнивается с участком на 4 см ниже стеноза и вычисляется коэффициент. Удвоение ПСС отражает 50% степень стеноза. При большой степени стеноза ПСС ниже его уровня уменьшается и время достижения ПСС замедляется. При очень больших степенях стеноза, таких как окклюзия, нормальная трехфазная допплеровская кривая меняется на монофазную, а также возрастает диастолическая скорость кровотока. При окклюзирующих поражениях бедренной артерии основным анастомозом в области бедра служит глубокая артерия бедра. Чувствительность и специфичность дуплексного сканирования в диагностики окклюзии и стеноза свыше 50% составляет 80-90%. Полная окклюзия при ЦДК выявляется с чувствительностью больше 90%. По сравнению с ДСА дуплексное сканирование имеет тенденцию к преувеличению степени стеноза. Достаточно высокая точность дуплексного сканирования позволяет сократить количество ангиографических исследований при решении вопроса о необходимости ангиопластики.
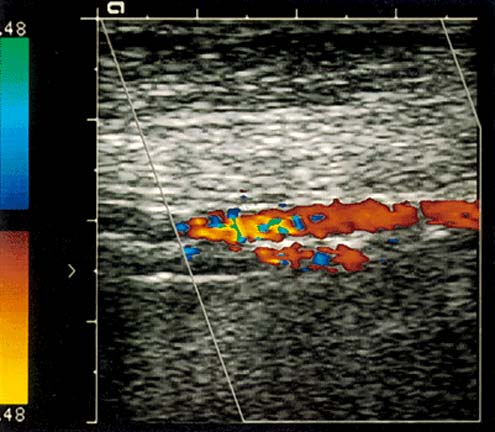
Изображение средней поверхностной бедренной артерии при продольном сканировании в ЦДК. Увеличенный кровоток в участке стеноза.
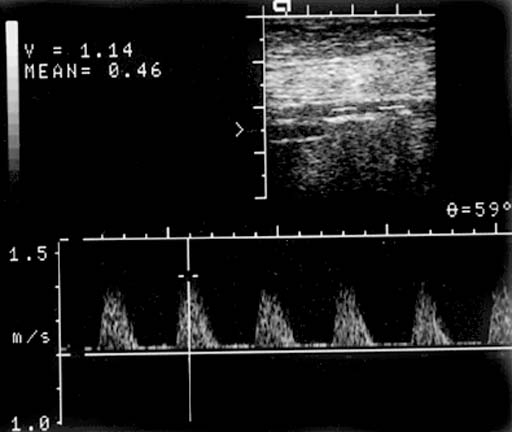
Кровоток проксимальнее участка стеноза (см.предыдущий рис.). Базовая ПСС немного увеличена до 114 см/с.
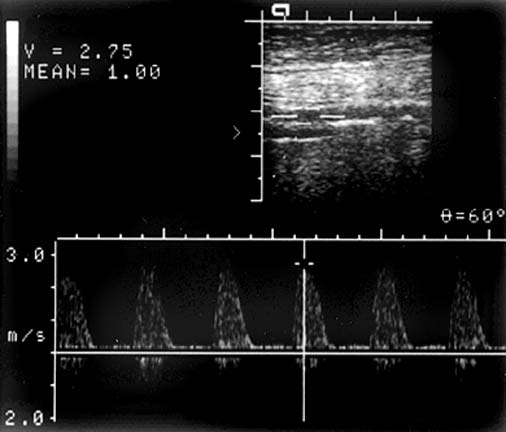
Кровоток в участке стеноза. ПСС увеличена до 275 см/с. Коэффициент скорости кровотока определяется как отношение ПСС в участке стеноза к базовой ПСС (275 к 114 в данном примере), что дает степень стеноза между 50 и 75%.
Окклюзия обходных сосудов
Дуплексное сканирование служит главным методом послеоперационной оценки состояния обходных сосудов. Искусственные обходные сосуды легко визуализируются при УЗ исследовании. Нередко в стенке искусственного сосуда виден газ, что облегчает распознавание просвета сосуда в раннем послеоперационном периоде. При УЗ исследовании также хорошо видны гематомы и псевдоаневризмы, прилегающие к сосуду. Стенозы при обходных сосудах чаще возникают в зоне анастомоза вероятно, в связи с фиброзной гиперплазией интимы. Они появляются примерно через 2 года после операции. Если обходной сосуд формируется из аутологичной вены, ее диаметр в области проксимального и дистального анастомоза может отличаться. Скорости кровотока в обходном сосуде должны быть такими же, как и в нормальной артерии. Однако диастолический обратный кровоток может быть коротким и невыраженным. Нарушение проходимости обходного сосуда в первый месяц после операции связано с проблемами, возникшими непосредственно в ее ходе, такими как повреждение зажимом, плохими анастомозами. Другой причиной может быть открытие артериовенозных фистул сразу после операции. По прошествию критического месяца стеноз связывают с фиброзной гиперплазией интимы. В начальной степени стеноза скорость кровотока увеличивается. Уменьшение пиковой скорости кровотока до 45 см/с в обходном сосуде обычного (около 3 см) диаметра говорит о выраженном затруднении кровотока. На последней стадии наблюдается тромбоз и полное отсутствие кровотока в обходном сосуде. Сужение диаметра обходного сосуда на 70% и больше в раннем послеоперационном периоде практически всегда приводит к полной окклюзии через 3-6 месяцев и требует безотлагательной повторной оперции. Стенозы 50-70% приводят к последующей полной окклюзии только у 30% пациентов и, поэтому, требуют дальнейшего наблюдения. Дуплексное сканирование может служить для отбора пациентов для чрезкожной ангиопластики и атерэктомия, контроля за выполнением интервенционной процедуры и последующего мониторирования результатов.
Место отхождение искусственного сосуда (G) от поверхностной бедренной артерии (SFA). Сканирование в В-режиме. Типичных для тромбов эхогенных сигналов не визуализируется.
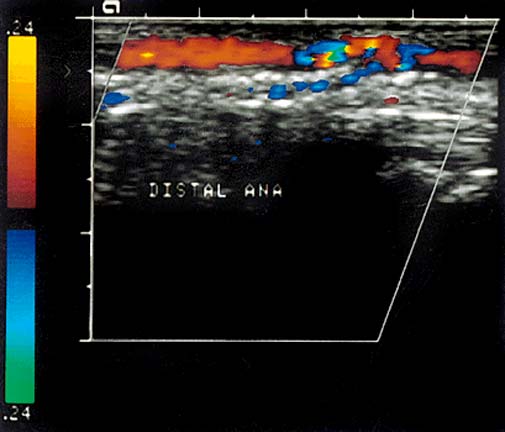
Дистальный анастамоз передней и задней берцовой артерии, обходной сосуд выполнен аутологичной веной. Кровоток ускорен, что видно синим в режиме ЦДК.
Аневризмы и артериовенозные фистулы.
УЗ исследование в серой шкале остается стандартом выявления периферических аневризм. Для аневризм характерен турбулентный поток в режиме ЦДК и короткий двунаправленный систолический сигнал на кривой допплеровского спектра сдвига частот. Артериовенозные фистулы вызывают зону повышенной скорости кровотока между артерией и соседней веной и, соответственно, снижение индекса сопротивления. Дистальнее артериовенозной фистулы ПСС имеет нормальные или сниженные значения. Может наблюдаться расширение приводящего артериального ствола и диаметра отводящей вены проксимальнее фистулы. Нередкой находкой являются псевдоаневризмы в области хирургического анастомоза или входа катетера. Псевдоаневризмы могут спонтанно тромбироваться.
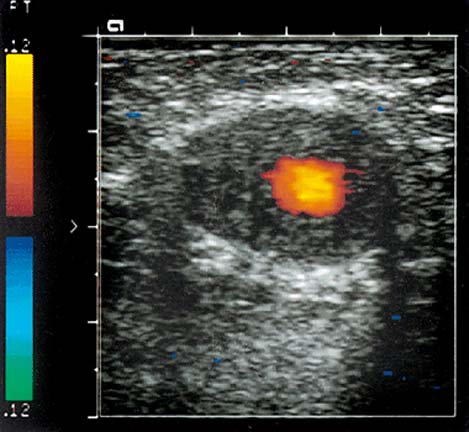
Аневризма бедренной артерии. Сканирование в поперечной плоскости в ЦДК. Слабоэхогенная зона, окружающая аневризму отражает формирование тромба.
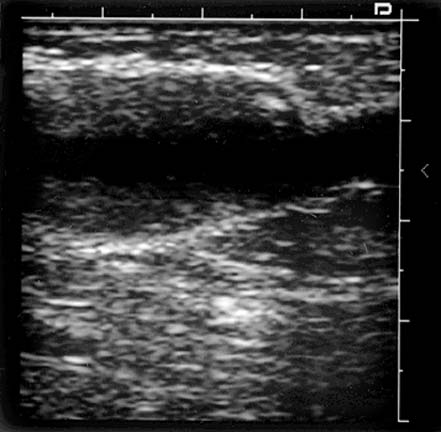
Частично тромбированная аневризма (см. предыдущий рис.). Продольное сканирование в В-режиме. Стенка сосуда по внешним границам расширена почти до 2 см (норма около 7 мм), просвет сосуда остается 5-7 мм в связи с тромбированием.
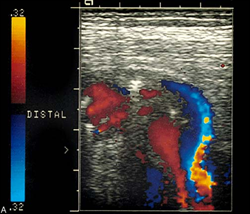
Артериовенозная фистула. Сканирование в ЦДК показывает прерывистый кровоток между артерией (поверхностно) и веной (глубоко).
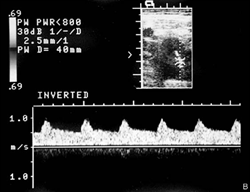
Артериовенозная фистула (см. предыдущий рис.). Допплеровская кривая, полученная от соединяющих каналов, подтверждает артериальный кровоток с низким сопротивлением.

Псевдоаневризма (см. предыдущий рис.). Кровоток типа «туда и обратно» отражает наполнение в систолу и опорожнение в диастолу.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ КРОВОТОКА В ПЕРИФЕРИЧЕСКИХ ВЕНАХ
Стандартным подходом к обследованию пациентов с очевидным клиническим подозрением на тромбоз глубоких вен является выполнение ультразвукового исследования. Применение нашли и более сложные методы. КТ-венография обладает достаточно высокой точностью, но требует введения йодного контраста и сопровождается высокой лучевой нагрузкой. МР-венография дает много ложно-положительных результатов. Наиболее целесообразно её применение для исследования вен таза, где ультразвуковое исследование неэффективно. Классическая рентгеноконтрастная венография остается последним методом, выполняемым только по особым показаниям. Например, у тучных пациентов или при выраженном отеке ноги, когда ультразвуковое исследование дает неопределенные результаты.
Анатомия венозного русла нижних конечностей
Венозный дренаж из нижних конечностей осуществляется по глубоким и поверхностным венам. Начиная от стопы, глубокие вены служат магистральными путями и идут парно с одноименными артериями. Передние большеберцовые вены дренируют кровь от тыльных плюсневых вен стопы, вен подошвенной поверхности (через анастомозы) и мышц передней поверхности голени. Они хорошо визуализируются, так как лежат кпереди от межкостной перепонки, между большой и малой берцовыми костями. Задние большеберцовые вены начинаются от латеральных подошвенных вен, в которые попадает венозная кровь из подошвенной венозной дуги. В задние большеберцовые вены впадают малоберцовые вены, а также безклапанные вены, дренирующие мышцы задней поверхности голени. Задние большеберцовые вены расположены глубже передних и хуже визуализируются. Сливаясь в верхней трети голени, передние и задние большеберцовые вены образуют подколенную вену. Она расположена в подколенной ямке латеральнее и кзади от подколенной артерии. В 30-35% случаев наблюдается удвоенная подколенная вена. В подколенную вену впадают вены колена и малая подкожная вена, собирающая кровь от латеральной и задней поверхностей стопы и голени. Проходя через отверстие в сухожилии (canalis adductorius) большой мышцы, отводящей бедро, подколенная вена переходит в бедренную. Бедренная вена расположена в глубине canalis adductorius позади и латеральнее бедренной артерии, в средней трети бедра позади нее, а затем медиальнее. В 20-30% наблюдается удвоенная бедренная вена. В области canalis adductorius бедренная вена хуже визуализирутся, так как закрыта толщей тканей. В бедренную вену впадают мелкие вены, собирающие кровь от мышц передней поверхности бедра, и большая подкожная вена. После слияния с глубокой веной бедра на 8-10 см ниже паховой связки, бедренная вена обозначается как общая бедренная вена. В 30-40% случаев подколенная вена и глубокая вена бедра анастомозируют. Общая бедренная вена переходит в наружную подвздошную вену, которая расположена от паховой связки до крестцово-подвздошного сочленения. В наружную подвздошную вену впадают нижние подчревные вены и глубокая вена, огибающая подвздошную кость. После слияния наружной подвздошной вены с внутренней подвздошной веной, собирающей кровь от стенок и органов таза, на уровне крестцово-подвздошного сочленения начинается общая подвздошная вена. Некоторые анатомические особенности строения внозного русла могут быть предпосылкой к развитию тромбоза (табл.1). Наиболее частой анатомической предпосылкой к тромбозу является сдавление левой общей подвздошной вены при пересечении её с правой общей подвздошной артерией.
Табл.1. Связь между тромбозом глубоких вен и их анатомическими особенностями
| Анатомические особенности | Связь с тромбозом |
| Удвоение большеберцовых и малоберцовых вен (близко к 100%) | Увеличение количества клапанов, которые служат местом венозного стаза и формирования тромбов |
| Большое количество клапанов в большеберцовых и малоберцовых венах | Увеличение количества мест для формирования тромбов |
| Большие венозные синусы в икроножной мышце | Места стаза, что индуцирует формирование тромбов |
| Большее количество клапанов в венах голени, чем в венах бедра | Большая вероятность формирования тромбов в венах голени, чем бедра |
| Удвоение подколенной вены (30-40%) и бедренной вены (20-30%) | Увеличение количества клапанов и повышенние вероятности формирование тромбов |
| Отсутствие клапанов в общей бедренной вене | Сниженная вероятность изолированного тромбоза |
| Впадение большой подкожной вены в общую бедренную вену | Распространение поверхностного тромбоза в общую бедренную вену |
Типы венозного кровотока в норме
Кровоток по магистральным венам непрерывного типа, на который накладываются циклические изменения в связи с дыхательными движениями (табл.2). Во время вдоха кровоток уменьшается, так как возрастает давление в брюшной полости. Во время выдоха кровь возвращается и кровоток возрастает. Такой циклический тип наиболее выражен в общей бедренной и проксимальных бедренных венах, но меньше в подколенной и задних большеберцовых венах. В малоберцовых и передней бедренной венах он может не наблюдаться. В поверхностных и перфорирующих венах кровоток прерывистый. При сжатии икроножной мышцы, либо сгибании или разгибании стопы, вены опорожняются и ультразвуковой сигнал усиливается. Дыхательная цикличность подтверждается допплеровской кривой или ЦДК.
Табл.2. Типы венозного кровотока в норме
| Тип венозного кровотока | Анатомические и физиологические причины |
| Циклический тип | Нормальный, связанный с дыханием |
| Усиление венозного кровотока после сдавливания голени или сгибания стопы | Опустошение вен голени с усилением скорости кровотока |
| Сигналы низкой скорости в подкожных венах | Малый объем кровотока от кожи в подкожные вены; кровоток также идет из поверхностных в глубокие вены через перфорирующие вены |
| Уменьшение венозного кровотока при приеме Вальсальвы или глубоком дыхании | Увеличение давления в брюшной полости и уменьшение венозного возврата |
| Кратковременный обратный кровоток при приеме Вальсальвы | Может быть необходимо некоторое количество крови для закрытия клапанов |
Клиническая картина острого тромбоза глубоких вен нижних конечностей
Клиническая картина при остром тромбозе глубоких вен определяется внезапно возникшим нарушением венозного оттока при сохраненном притоке артериальной крови. Она во многом зависит от протяженности тромботического процесса, скорости образования, степени и быстроты распространения в дистальном и особенно в проксимальном направлении. Пациенты жалуются на острую распирающую боль в области икроножных мышц и по ходу сосудистого пучка. Наблюдается отек мышц стопы и голени, цианоз кожи, повышение локальной температуры, переполнение подкожных вен стопы. Перечисленные симптомы неспецифичны и могут отсутствовать. При физикальном исследовании наблюдается усиление боли при тыльном сгибании стопы из-за натяжения икроножных мышц и сдавления вен (симптом Хоманса), болезненность голени при передне-заднем сдавлении (симптом Мозеса), боли в икроножных мышцах при давлении манжетки сфигмоманометра до 150 мм рт.ст. (симптом Ловенберга). Наблюдаются также общие симптомы асептического воспаления.
Ультразвуковая картина нарушения венозного оттока
Отсутствие допплеровского сигнала от венозного сегмента говорит о его окклюзии или обструкции проксимальнее сегмента. В случае проксимальной обструкции невозможно сказать, является ли она внутренней, или наружной, как следствие компрессии более проксимальной вены. Уровень нарушений должен быть визуализирован непосредственно. Выраженная пульсация наблюдается при сердечной недостаточности правых камер сердца и проявлением регургитации трехстворчатого клапана. Стеноз приводит к ускорению венозного кровотока. При этом фазность в связи с дыханием может уменьшаться или совсем исчезать. Для замедления венозного оттока можно использовать прием Вальсальвы. Он доказывает, что исследуется именно вена, а не артерия. При венозной недостаточности прием Вальсальвы приводит к обратному кровотоку. То же может наблюдаться и при сдавливании конечности проксимальнее области измерения.
Острый венозный тромбоз
Острый венозный тромбоз всегда гипоэхогенный в серой шкале (табл.3). Отсутствие реакции на компрессию извне является наилучшим критерием острого венозного тромбоза. Вену сдавливают через кожу, датчик устанавливают над веной с вводом 1-2 см. Затем давление снимают и датчик переставляют по ходу вен. Полное отсутствие сигналов кровотока при дуплексном исследовании и ЦДК предполагает полный тромбоз . Ложно-положительный результат встречается, когда имеет место более проксимальная обструкция, например, компрессия подвздошной вены извне. При этом уменьшается венозный возврат. Цветовые сигналы могут наблюдаться по периферии тромба, если он вызывает частичную обструкцию. При этом, в нетромбированном участке вены отмечаются допплеровские сигналы. ЦДК позволяет отличать полный и частичный тромбозы. Нормальное ускорение кровотока исключает полный тромбоз проксимальной вены, за искючением случаев, когда хорошо развиты коллатерали или тромбированная вена дублируется. Внешняя компрессия вен может быть обусловлена разными причинами: кистой Бейкера в подколенной ямке, увеличенным лимфатическим узлом, лимфатическим отеком. Обструктивный венозный тромбоз обычно наблюдается у больных с клиническими проявлениями, часто амбулаторных. Для диагностики тромбоза вен голени точность УЗ исследования составляет свыше 97%. При сочетании с проксимальным венозным тромбозом точность чуть ниже в связи с отеком. Послеоперационные венозные тромбы чаще необструктивные. Они начинаются от вен голени или от области клапанов в бедренной и подколенной венах. Для выявление таких тромбов требуется тщательное исследования по всему ходу вен. При необструктивном венозном тромбозе по периферии тромба могут быть гиперэхогенные сигналы от фибрина, вена не расширена. Диагностическая точность УЗ исследования для выявления острого послеоперационного тромбоза составляет от 70 до 90%. Диагностическая точность УЗ исследования для выявления тромбоза подколенной и бедренной вен составляет 80-90%. Чаще всего не выявляются мелкие тромбы (до 1 см). При изолированном тромбозе вен голени чувствительность метода не превышает 50%. Визуализация подвздошных вен составляет проблему в связи с наличием газа в кишке.
Табл.3. Признаки острого венозного тромбоза при УЗ-исследовании
| Признак | Корреляция с патологическими изменениями |
| Нет реакции на сдавление | Тромб ведет себя как объемное образование в венозном сегменте |
| Отсутствие кровотока в венозном сегменте | Тромб перекрывает венозный отток |
| Обратный кровоток в невовлеченном сегменте | Тромб перекрывает венозный отток |
| Изоэхогенные или гипоэхогенные сигналы, «губкообразный» тромб | Тромб на ранней стадии – состоит их фибриновой массы с включением эритроцитов |
| Гетерогенный сигнал | Связан с активацией литических процессов в тромбе |
| Расширение вены | Тромб занимает больший объем, чем кровь |
| Коллатеральный кровоток | Коллатеральные венозные каналы развиваются уже на ранней стадии тромбоза |

УЗ сканирование в В-режиме. Острый полный проксимальный тромбоз общей бедренной вены. Вена содержит эхогенный материал и расширена. Общая бедренная артерия расположена чуть выше и латеральнее вены.
УЗ сканирование в В-режиме. Острый тромбоз выше подколенной вены. Подколенная вена расширена и содержит слабоэхогенный материал.
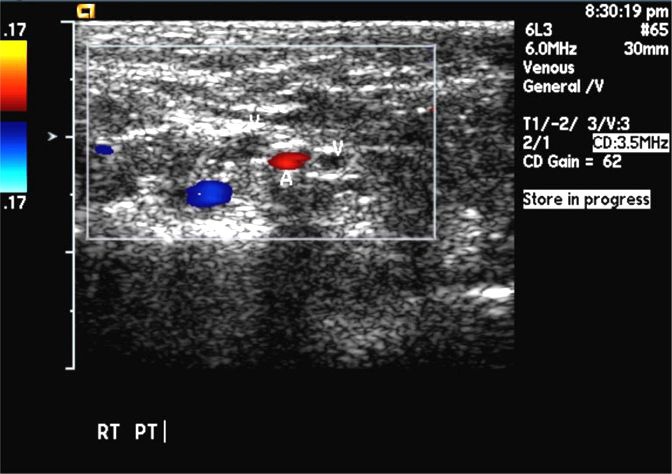
УЗ сканирование в режиме ЦДК. Двухсторонний тромбоз подколенной вены. Нормальный компрессионный тест поверхностной бедренной вены.
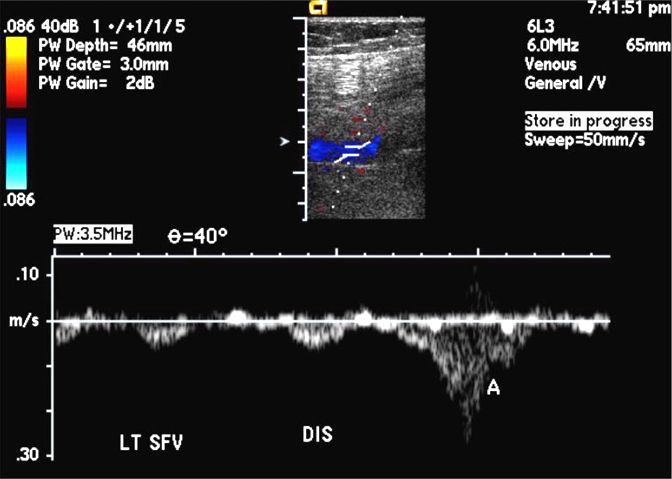
Дуплексное сканирование. Тромбоз подколенной вены. Компрессионный тест положительный (нет реакции на компрессию).
Хронический венозный тромбоз
После острого эпизода венозного тромбоза наблюдается полная или частичная реканализация, но остается повреждение клапанов и, как следствие, хроническая венозная недостаточность (рефлюкс). Признаки хронического венозного тромбоза при УЗ-исследовании представлены в табл.4. Обнаружить рефлюкс можно используя прием Вальсальвы или компрессией конечности выше исследуемой области, либо вызывая венозный прирост сдавливая голень в положении больного стоя. Кратковременный (до 0,5с) обратный кровоток является нормальным физиологическим явлением в общей бедренной вене, глубокой бедренной вене и подколенной вене. При ЦДК физиологический рефлюкс может казаться чуть дольше. Более продолжительный обратный кровоток, особенно, превышающий 1,0с говорит о венозной недостаточности. Табл.4. Признаки хронического венозного тромбоза при УЗ-исследовании.
| Признак | Корреляция с патологическими изменениями |
| Нет реакции на сдавление | Тромб ведет себя как объемное и частично обструктирующее образование в венозном сегменте |
| Сниженный кровоток в венозном сегменте | Отток осуществляется через коллатерали |
| Обратный кровоток при приеме Вальсальвы | Поврежденные клапаны способствуют рефлюксу |
| Изоэхогенные или гипоэхогенные сигналы | Тромб в хронической стадии связан со стенкой вены |
| Гетерогенный сигнал | Связан с активацией литических процессов в тромбе |
| Варикозное расширение поверхностных вен | Вовлечение перфорирующих вен приводит к разрушению клапанов и рефлюксу из глубоких в периферические вены |
| Нормальный или уменьшенный диаметр вен | Тромб в хронической стадии не увеличивает диаметр вены |
Сравнение острого и хронического тромбоза глубоких вен
Хронический тромбоз глубоких вен типично приводит к утолщению стенки вены или циркулярному мягкотканному образованию, прилежащему к ее стенке (табл.5). Диаметр вены не меняется, либо уменьшается. Эхо-сигналы обычно однородные, изо- или аэхогенные. Цветовые сигналы при ЦДК расположены в середине просвета вены. При остром венозном тромбозе, в отличие от хронического, тромб расположен в середине и вена расширена. Табл.5. Сравнение острого обструктивного, острого необструктивного и хронического тромбозов глубоких вен
| острый обструктивный | острый необструктивный | хронический |
| Вена расширена | Вена нормально диаметра | Вена нормального или уменьшенного диаметра |
| Нет реакции на сдавление, «губкообразна» | Нет реакции на сдавление | Нет реакции на сдавление |
| Гипоэхогенные или изоэхогенные сигналы | Гипоэхогенные или изоэхогенные сигналы, могут быть эхогенные сигналы по периферии | изоэхогенные или слегка гиперэхогенные сигналы |
| Полная обструкция кровотока | Нет обструкции | Нет обструкции |
| Центральное расположение тромба | Центральное или чуть эксцентричное расположение тромба с окружающим его кровотоком | Периферическое расположение тромба с кровотоком в центре вены |
| Нет варикоза | Нет варикоза | Варикоз очень вероятен |
| Могут быть коллатерали | Нет коллатералей | Коллатеральные каналы очень вероятны |
| Нет венозного рефлюкса | Нет венозного рефлюкса | венозный рефлюкс возможен |

Сравнение хронического (верхняя диаграмма) и острого (нижняя диаграмма) венозных тромбозов. Вокруг участка хронического тромбоза развиваются коллатерали, в одной из них показан тромбоз (верхний рис.справа). Участок тромбоза в вене расположен по периферии (нижний рис.справа). Острый венозный тромбоз развивается в центре, кровоток окружает тромб.
Остались вопросы? Звоните +7 (812) 493-39-22 или оставьте свои данные и мы Вам перезвоним!

(812) 493-39-22
или заполните форму
Сайт
google-site-verification